题目内容
(共12分)某同学利用以下装置制备氨气并探究氨气的还原性。
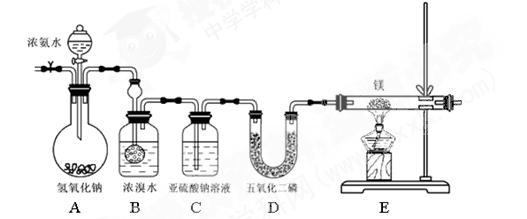
实验步骤及现象:①连接仪器并检验装置气密性②通入惰性气体(不与镁反应),排出装置中的空气③打开分液漏斗活塞,观察到B中浓溴水颜色变浅至褪色,C中产生无色气泡④点燃酒精灯,观察E中固体变成了黄绿色。
查阅资料:氮化镁是黄绿色固体,遇水剧烈反应生成两种碱。
请回答下列问题:
(1)A中氢氧化钠的作用为 (用简要的语言和方程式来说明)
(2)写出B处反应的化学方程式
(3)亚硫酸钠的作用
(4)此装置有不足之处,请说明
(5)某同学要继续探究E中固体成分。将E中的固体放入稀盐酸中,观察到固体溶解并产生气泡,写出此过程中反应的化学方程式

实验步骤及现象:①连接仪器并检验装置气密性②通入惰性气体(不与镁反应),排出装置中的空气③打开分液漏斗活塞,观察到B中浓溴水颜色变浅至褪色,C中产生无色气泡④点燃酒精灯,观察E中固体变成了黄绿色。
查阅资料:氮化镁是黄绿色固体,遇水剧烈反应生成两种碱。
请回答下列问题:
(1)A中氢氧化钠的作用为 (用简要的语言和方程式来说明)
(2)写出B处反应的化学方程式
(3)亚硫酸钠的作用
(4)此装置有不足之处,请说明
(5)某同学要继续探究E中固体成分。将E中的固体放入稀盐酸中,观察到固体溶解并产生气泡,写出此过程中反应的化学方程式
(共12分)
(1)①氢氧化钠溶水放热,降低氨的溶解度②溶液中含有大量的OH-,使NH3+H2O
NH3H2O OH-+NH4+平衡逆向进行(3分,平恒关系式1分,理由答对一条给1分)
OH-+NH4+平衡逆向进行(3分,平恒关系式1分,理由答对一条给1分)
(2)3Br2+8NH3=6NH4Br+N2(或3Br2+2NH3=6HBr+N2) (2分)
(3)除去氮气中混有的溴(除去少量的氨气) (1分)
(4)空气中的水进入E装置,遇氮化镁生成氨气,污染环境。(C中可能发生倒吸现象,应该防倒吸) (2分)
(5)Mg3N2+8HCl=3MgCl2+2NH4Cl , Mg+2HCl=MgCl2 +H2↑ (4分)
(1)①氢氧化钠溶水放热,降低氨的溶解度②溶液中含有大量的OH-,使NH3+H2O

NH3H2O
 OH-+NH4+平衡逆向进行(3分,平恒关系式1分,理由答对一条给1分)
OH-+NH4+平衡逆向进行(3分,平恒关系式1分,理由答对一条给1分)(2)3Br2+8NH3=6NH4Br+N2(或3Br2+2NH3=6HBr+N2) (2分)
(3)除去氮气中混有的溴(除去少量的氨气) (1分)
(4)空气中的水进入E装置,遇氮化镁生成氨气,污染环境。(C中可能发生倒吸现象,应该防倒吸) (2分)
(5)Mg3N2+8HCl=3MgCl2+2NH4Cl , Mg+2HCl=MgCl2 +H2↑ (4分)
略

练习册系列答案
相关题目
 调控。
调控。 装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。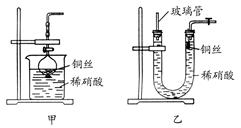
 状况下________mL O2才能使NO全部溶于水。
状况下________mL O2才能使NO全部溶于水。
 + xI-+ yH+ = 2NO↑+ I2 + zH2O,请回答下列问题:
+ xI-+ yH+ = 2NO↑+ I2 + zH2O,请回答下列问题: 含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列
含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列