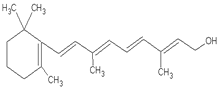
题目内容
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+,极少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
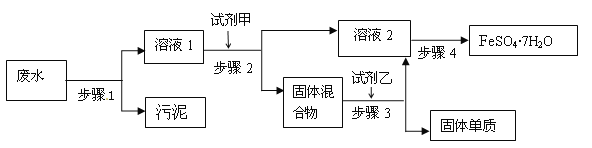
(1)步骤1的主要操作是___,需用到的玻璃仪器除烧杯外还有___。
(2)固体混合物是____(填化学式)
(3)步骤3中发生反应的化学方程式为___。
(4)步骤4中涉及的操作是:蒸发浓缩、___、过滤、洗涤、干燥。
(5)火法制得的粗铜中常混有少量氧化亚铜(Cu2O),氧化亚铜溶于稀硫酸溶液变蓝。试写出该反应的离子方程式___。
【答案】过滤 漏斗、玻璃棒 Fe、Cu Fe+H2SO4=FeSO4+H2↑ 冷却结晶 Cu2O+2H+=Cu2++Cu+H2O
【解析】
已知某工业废水中含有大量FeSO4,较多的Cu2+,极少量的Na+以及部分污泥,通过过滤得到溶液1,含有大量FeSO4,较多的Cu2+,极少量的Na+;加入足量的铁粉,置换出金属铜,得到固体混合物铁和铜;过滤,得到溶液2,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到FeSO47H2O晶体;固体混合物铁和铜加入足量的硫酸,得到硫酸亚铁溶液进入溶液2中,同时剩余铜固体,据以上分析解答。
(1)步骤1用于分离固体和液体,为过滤操作,需要用到的玻璃仪器有烧杯、漏斗、玻璃棒;
故答案为:过滤;漏斗、玻璃棒;
(2)由上述分析可知,固体混合物含Fe、Cu;
故答案为:Fe、Cu;
(3)步骤3中发生反应的离子方程式为Fe+H2SO4═FeSO4+H2↑;
故答案为:Fe+H2SO4═FeSO4+H2↑;
(4)步骤4中涉及的操作是:蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到FeSO47H2O晶体,故答案为:冷却结晶;
(5)氧化亚铜与稀硫酸反应,溶液变蓝,发生离子反应为Cu2O+2H+=Cu2++Cu+H2O;
故答案为:Cu2O+2H+=Cu2++Cu+H2O。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】一定温度下,在三个容积均为![]() 的恒容密闭容器中按不同方式投入反应物,发生反应
的恒容密闭容器中按不同方式投入反应物,发生反应![]()
![]() ,测得反应的相关数据如下:
,测得反应的相关数据如下:
容器 | 容器Ⅰ | 容器Ⅱ | 容器Ⅲ |
反应温度 | 600 | 600 | 800 |
反应物投入量 |
|
|
|
平衡 |
|
|
|
平衡 |
|
|
|
平衡体系总压强 |
|
|
|
物质的转化率 |
|
|
|
平衡常数K |
|
|
|
下列叙述正确的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()