题目内容
【题目】(1)柠檬 酸是 一种 重 要的 有 机 酸 ,其结构简式 为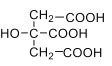 , 其电离常数K1=7.41×10-4,K,2=1.74×10-5,K3=3.98×10-7。碳酸的电离常数K1=4.5×10-7,K1=4.7×10-11。请回答下列有关问题:
, 其电离常数K1=7.41×10-4,K,2=1.74×10-5,K3=3.98×10-7。碳酸的电离常数K1=4.5×10-7,K1=4.7×10-11。请回答下列有关问题:
①设计实验证明柠檬酸的酸性比碳酸强:___。
②设计实验证明柠檬酸为三元酸:___。
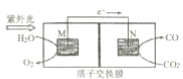
(2)绿色电源“二甲醚-氧气燃料电池”的工作原理如图所示。
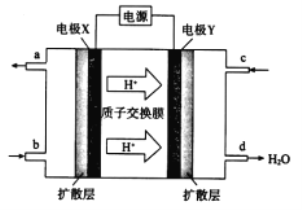
①氧气应从 c 处通入,则电极 Y 上发生反应的电极反应式为___。
②二甲醚(CH3OCH 3 )应从 b 处通入,则电极 X上发生反应的电极反应式为___。
【答案】向盛有少量NaHCO3溶液的试管里滴加柠檬酸溶液,有气泡产生(或其他合理设计) 用NaOH标有溶液滴定柠檬酸溶液,消耗NaOH的物质的量是柠檬酸的3倍 O2+4e﹣+4H+═2H2O (CH3)2O﹣12e﹣+3H2O=2CO2+12H+
【解析】
(1)①要证明柠檬酸的酸性比碳酸强,可以利用强酸制取弱酸分析;
②利用酸碱中和滴定酸碱物质的量比确定柠檬酸是三元酸;
(2)根据氢离子移动方向知,Y为原电池正极,X为负极,则c处通入的气体是氧气,根据d处生成物知,正极上发生的反应为O2+4e-+4H+═2H2O,电解质溶液为酸性溶液,b处通入的物质是二甲醚,X电极反应式为(CH3)2O-12e-+3H2O=2CO2+12H+,据此分析解答。
(1)①要证明柠檬酸的酸性比碳酸强,可以利用强酸制取弱酸,向盛有少量NaHCO3的试管里滴加柠檬酸溶液,有气泡产生就说明柠檬酸酸性大于碳酸,
因此,本题正确答案是:向盛有少量NaHCO3溶液的试管里滴加柠檬酸溶液,有气泡产生(或其他合理设计);
②柠檬酸和NaOH发生中和反应时,如果柠檬酸是三元酸,则参加反应的NaOH物质的量应该是柠檬酸的三倍,所以用NaOH标准溶液滴定柠檬酸溶液,消耗NaOH的物质的量是柠檬酸的3倍就说明柠檬酸是三元酸,
因此,本题正确答案是:用NaOH标有溶液滴定柠檬酸溶液,消耗NaOH的物质的量是柠檬酸的3倍;
(2)①c处通入的气体是氧气,根据d处生成物知,正极上发生的反应为O2+4e-+4H+═2H2O,因此,本题正确答案是:O2+4e-+4H+═2H2O;
②b处通入的物质是二甲醚,X电极反应式为(CH3)2O-12e-+3H2O=2CO2+12H+,
因此,本题正确答案是:(CH3)2O-12e-+3H2O=2CO2+12H+。

 高中必刷题系列答案
高中必刷题系列答案