题目内容
有A、B、C、D、E、F六种短周期元素,它们的核电荷数按C、F、A、B、D、E的顺序增大。已知E、F位于同一主族;C、D都能分别与A按原子个数比为1∶1 或2∶1形成化合物;CB是一种10e- 的气态分子;E的M层电子数是K层电子数的2倍。
(1)写出下列元素的名称:B ,E ,F ;
(2)写出E在元素周期表中的位置第 周期第 族;
(3)写出D2A2的电子式 ;EB4
(4)用电子式表示FA2的形成过程 ;
(5)比较元素E和F的非金属性强弱,E的非金属性 于F(填“强”或“弱”),并用化学方程式证明上述结论 ;
(6)以上A、B、C、D中某些元素可形成的既含离子键又含非极性共价键的化合物是 ;既含离子键又含极性共价键的化合物是 。(写化学式)
(1)写出下列元素的名称:B ,E ,F ;
(2)写出E在元素周期表中的位置第 周期第 族;
(3)写出D2A2的电子式 ;EB4
(4)用电子式表示FA2的形成过程 ;
(5)比较元素E和F的非金属性强弱,E的非金属性 于F(填“强”或“弱”),并用化学方程式证明上述结论 ;
(6)以上A、B、C、D中某些元素可形成的既含离子键又含非极性共价键的化合物是 ;既含离子键又含极性共价键的化合物是 。(写化学式)
(1) B氟 E硅 F 碳(各1分)
(2)第三周期第IVA族(各1分)
(3)
 (各1分)
(各1分)
(4)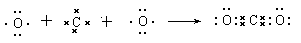 (2分)
(2分)
(5)弱,(1分) Na2SiO3 + H2O + CO2 ="==" H2SiO3↓+ Na2CO3
或Na2SiO3 + 2H2O + 2CO2 ="==" H2SiO3↓+ 2NaHCO3(2分)
(6)Na2O2 NaOH(各1分)
(2)第三周期第IVA族(各1分)
(3)

 (各1分)
(各1分)(4)
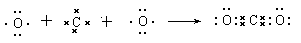 (2分)
(2分)(5)弱,(1分) Na2SiO3 + H2O + CO2 ="==" H2SiO3↓+ Na2CO3
或Na2SiO3 + 2H2O + 2CO2 ="==" H2SiO3↓+ 2NaHCO3(2分)
(6)Na2O2 NaOH(各1分)
E的M层电子数是K层电子数的2倍,则E是硅元素,所以F是碳元素。
CB是一种10e- 的气态分子,因此是HF,即C是氢元素,B是氟元素。C、D都能分别与A按原子个数比为1∶1 或2∶1形成化合物,所以A是氧元素,又因为核电荷数按C、F、A、B、D、E的顺序增大,所以D是钠元素,
CB是一种10e- 的气态分子,因此是HF,即C是氢元素,B是氟元素。C、D都能分别与A按原子个数比为1∶1 或2∶1形成化合物,所以A是氧元素,又因为核电荷数按C、F、A、B、D、E的顺序增大,所以D是钠元素,

练习册系列答案
相关题目

 Nd、
Nd、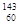 Nd和
Nd和 Nd互为同素异形体
Nd互为同素异形体
 ( )
( )