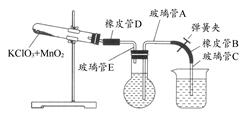
题目内容
等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
(1)在Fe、Zn、Cu中,A是__________,B是____________。
(2)将两种金属粉末按一定比例混合后,进行甲、乙、丙三组实验,三组实验各取500mL同浓度的盐酸加入该种混合粉末,有关数据如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 混合粉末质量/g | 6.2 | 18.6 | 24.8 |
| 生成气体体积(标准状况下)/mL | 2240 | 5600 | 5600 |
计算上述所用盐酸的物质的量浓度(写出计算过程)中。

解析试题分析:(1)根据图像可以看出,等质量的A与盐酸反应速率慢但产量多,B反应速率快但产量少,所以A为Fe,B为Zn.
(2)要计算盐酸的浓度,首先找出盐酸完全反应的实验,可以假设甲、乙中金属完全完全反应,按等比求出乙产生的氢气,与实际值比较,可得出乙中盐酸不足,完全反应;也可以根据丙中金属质量大于乙,而产生的氢气相等,说明乙、丙中盐酸不足,完全反应,根据氢气5.6L,求出盐酸的浓度。
考点:本题考查金属单质与酸的反应及相关计算。

练习册系列答案
相关题目
Na2O2曾经是潜水艇或航天器中最理想的供氧剂。下表是人体呼出气体的成分(均为体积百分含最)。
| | 空气 成分 | 人体呼出 气体成分 |
| N2 | 78% | 74% |
| O2 | 21% | 16% |
| H2O | 0. 5% | 6% |
| CO2 | 0. 03% | 4% |
(1)已知一个人一天大约要产生16 mol CO2。若全部被Na2O2吸收,需要Na2O2________ g。
(2)若要使被吸收的CO2与产生的O2体积相等,就需
要在Na2O2中添加KO2.计算要达到该目的.Na2O2与KO2的物质的量比例是 。
已知:4KO2+2CO2=2K2CO3+3O2
(3)计算100 L空气经过人体呼吸后,呼出气体中O2的体积(标准状况下,保留2位小数)____ L。
(4)为保持航天器中空气成分恒定,并充分利用资源,需对人体呼出的气体进行处 理,无用物质排出航天器。100 L空气经过人体呼吸后,欲使呼出的气体经过处理后恢复原空气成分且体积仍为100 L(可供使用的化学试剂只有Na2O2).通过计算回答:若先利用CO2,还需要利用水蒸气,求需要水蒸气体积 L。
如图表示一些物质间的从属关系,不正确的是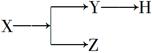
| | X | Y | Z | H |
| A | 分散系 | 胶体 | 溶液 | 烟 |
| B | 元素周期表的纵行 | 主族 | 副族 | 卤族 |
| C | 电解质 | 酸 | 碱 | 盐 |
| D | 化合物 | 共价化合物 | 离子化合物 | 酸 |
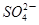 的物质的量浓度_____________mol/L;
的物质的量浓度_____________mol/L;