题目内容
(14分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH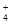 | SO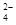 | NO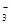 | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
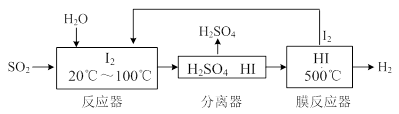
(2) NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
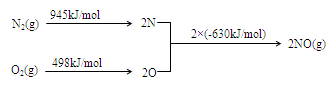
① N2(g)+O2(g)
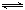 2NO(g)△H= 。
2NO(g)△H= 。②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
③ 汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现? 。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
① 用离子方程式表示反应器中发生的反应 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
③ 用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M
 NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
⑴ 4 ⑵① +183kJ/mol;② 2NO+2CO催化剂 2CO2+N2;③ 不能
⑶① SO2+I2+2H2O=SO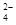 +2I-+4H+
+2I-+4H+
②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行
③MH+OH--e-=H2O+M
解析试题分析:(1)题目所示的微粒中阳离子所带的正电荷数是:4×10-6×1+6×10-6×1+2×10-5×1=3×10-5mol/L,阴离子所带的负电荷总数是:2×4×10-5+1×3×10-5+1×2×10-5=13×10-5 mol/L>3×10-5mol/L,根据溶液呈电中性原理,溶液中还应该含有大量的H+。所以溶液显酸性。c(H+)=13×10-5 mol/L-3×10-5mol/L=1×10-4 mol/L,所以pH="4." (2)①反应热就是断裂化学键吸收的热量与形成化学键释放的热量的差值。因此 N2(g)+O2(g 2NO(g)△H=+945KJ/mol+498KJ/mol-2×630KJ/mol=+183KJ/mol。②NO被CO还原的化学方程式为2NO+2CO催化剂 2CO2+N2;③由于该反应是体系混乱程度减小的吸热反应,体系的自由能大于0,所以设想是不能实现的。① 根据图示可知:用离子方程式表示反应器中发生的反应是:SO2+I2+2H2O=SO
2NO(g)△H=+945KJ/mol+498KJ/mol-2×630KJ/mol=+183KJ/mol。②NO被CO还原的化学方程式为2NO+2CO催化剂 2CO2+N2;③由于该反应是体系混乱程度减小的吸热反应,体系的自由能大于0,所以设想是不能实现的。① 根据图示可知:用离子方程式表示反应器中发生的反应是:SO2+I2+2H2O=SO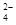 +2I-+4H+。②2HI(g)
+2I-+4H+。②2HI(g) H2(g)+I2(g). HI分解反应是可能反应。在反应中使用膜反应器分离出H2,减小生成物的浓度,平衡正向移动,有利于反应正向进行。③根据总反应方程式可知:在电池放电时,负极电极反应式为MH+OH--e-=H2O+M。
H2(g)+I2(g). HI分解反应是可能反应。在反应中使用膜反应器分离出H2,减小生成物的浓度,平衡正向移动,有利于反应正向进行。③根据总反应方程式可知:在电池放电时,负极电极反应式为MH+OH--e-=H2O+M。
考点:考查PM2.5的溶液的酸碱性、热化学方程式与化学键的关系、浓度对平衡移动的影响、离子方程式的书写、镍氢电池的电极反应式的书写的知识。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案(8分)化学反应的快慢和限度对人类生产生活有重要的意义。
(1)请将影响表中“实例”反应速率的“条件”仿照示例填在空格横线上。
| 实例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | 温度(示例) |
| ②实验室将块状药品研细,再进行反应 | ____________ |
| ③用H2O2分解制O2时,加入MnO2 | ____________ |
| ④工业制硫酸催化氧化SO2制取SO3时,通入过量的空气 | ____________ |

①写出该反应的化学方程式__________。
②从反应开始到10 s,用Z表示的反应速率为__________mol/(L·s)。
③该反应的化学平衡常数为__________(结果保留整数)。
④当反应进行到15 s时,向密闭容器中通入氩气,此时用Z表示的反应速率__________(填“小于”或“等于”或“大于”)10 s时用Z表示的反应速率。
(15分)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
①2H2(g)+CO(g)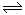 CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)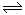 H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g)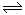 CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 | | |
(1)反应②是 (填“吸热”或“放热”)反应。
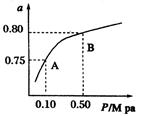
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如下图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
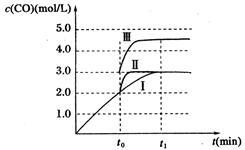
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
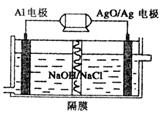
(4)甲醇燃料电池有着广泛的用途,同时Al—AgO电池是应用广泛的鱼雷电 池,其原 理 如右图所示。该电池的负极反应式是 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为 。
(16分)化工工业中常用乙苯脱氢的方法制备苯乙烯。
(1)已知某温度下:
反应①:CO2(g) +H2 (g)→CO(g) + H2O(g),ΔH= +41.2 kJ/mol
反应②: 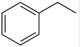 (g)→
(g)→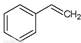 (g)+H2(g),ΔH=" +117.6" kJ/mol
(g)+H2(g),ΔH=" +117.6" kJ/mol
②的化学反应平衡常数分别为K1、K2。
请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
(2)对于反应①,恒温恒容条件下,向密闭容器中加入2molCO2和2molH2,当反应达到平衡后,以下说法正确的是 。
| A.因为该反应是吸热反应,所以升高温度,正反应速率增大,逆反应速率减小; |
| B.若继续加入1molCO2、1mol H2,平衡向正反应方向移动; |
| C.若继续通入1mol CO2则平衡向正反应方向移动,CO2的转化率增大; |
| D.压缩体积,平衡不移动,反应物和产物的浓度都不变; |
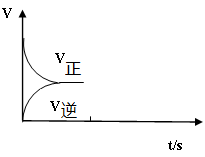
(4)已知某温度下, Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ksp(Ag2SO4)= ;(两位有效数字)
(5)电解法制备高铁酸钠(Na2FeO4),总反应式为:Fe+2H2O+2OH- = FeO42-+3H2,电解质溶液选用NaOH溶液。该电解池阳极材料是 (写化学式) ;阳极的电极反应式为: 。
 CO(g)+H2(g)
CO(g)+H2(g) 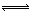 2NH3(g) ?H=—92.4kJ?mol?1
2NH3(g) ?H=—92.4kJ?mol?1
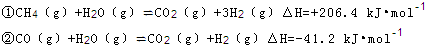
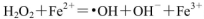
 ,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。


 .
.
 Cr2O72- (橙色)+H2O。
Cr2O72- (橙色)+H2O。