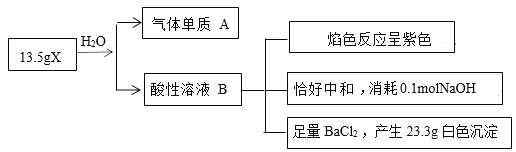
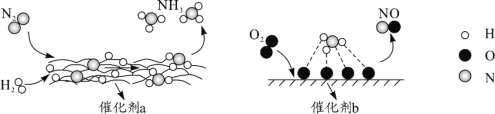
��Ŀ����
����Ŀ��25��ʱ����50mL����0.1molCl2����ˮ�еμ�2mol��L1��NaOH��Һ���õ���ҺpH�����NaOH��Һ����ı仯��ͼ��ʾ������˵����ȷ����
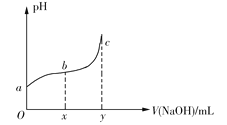
A.��a��pH=4����c(Cl)=mc(HClO)����HClO�ĵ���ƽ�ⳣ��Ϊ![]()
B.��x=100��b���Ӧ��Һ�У�c(OH)>c(H+)������pH��ֽ�ⶨ��pH
C.��y=200��c���Ӧ��Һ�У�c(OH)c(H+)=2c(Cl)+c(HClO)
D.b��c�Σ���NaOH��Һ�ĵ��룬![]() ������
������
���𰸡�C
��������
A��pH=4������Һ��c(H+)=104mol��L1�����ݷ���ʽ��Cl2+H2O![]() HCl+HClO��HClO
HCl+HClO��HClO![]() H++ClO����Һ��c(Cl)=c(ClO)+c(HClO)=mc(HClO)��c(HClO)=
H++ClO����Һ��c(Cl)=c(ClO)+c(HClO)=mc(HClO)��c(HClO)=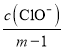 ��Ka(HClO)=
��Ka(HClO)=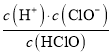 =
=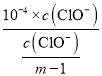 =104(m1)��A�����
=104(m1)��A�����
B�����ɵ�NaClO�е�ClOˮ�⣬�õ���HClO����Ư���ԣ�������pH��ֽ�ⶨ��Ӧ����Һ��pH��B�����
C��c��ʱ����ˮȫ����NaOH��Һ��Ӧ����NaClO��NaCl����n(Cl)=n(ClO)+n(HClO)�����ݵ���غ��У�n(Na+)+n(H+)=n(OH)+n(Cl)+n(ClO)�����������غ��У�n(ClO)+n(Cl)+n(HClO)=0.2mol��n(Na+)=0.4mol�����У�2n(ClO)+2n(Cl)+2n(HClO)+n(H+)=n(OH)+n(Cl)+n(ClO)�����У�c(OH)c(H+)=2c(Cl)+c(HClO)��C����ȷ��
D��b��c�Σ�����NaOH��Һ���룬c(HClO)Ũ����С��c(ClO)������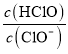 ��С��D�����
����D�����
��ѡC��

 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�