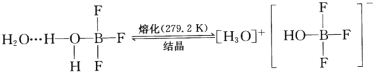
题目内容
【题目】对氨基苯甲酸(![]() )是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(
)是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(![]() )为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
)为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是

A.电子由金属阳极DSA经导线流入直流电源
B.阴极的主要电极反应式为![]() +6e-+6H+→
+6e-+6H+→![]() +2H2O
+2H2O
C.每转移1mole-时,阳极电解质溶液的质量减少8g
D.反应结束后阳极区pH增大
【答案】AB
【解析】
该装置为电解池,右侧生成氧气,则右侧为阳极,电极反应式为![]() ,左侧为阴极,据此分析解答。
,左侧为阴极,据此分析解答。
A. 该电解池右侧为阳极,失电子发生氧化反应,则电子由金属阳极DSA经导线流入直流电源,故A正确;
B. 阴极得电子发生还原反应生成氨基苯甲酸,则阴极的主要电极反应式为![]() +6e-+6H+→
+6e-+6H+→![]() +2H2O,故B正确;
+2H2O,故B正确;
C. 阳极发生反应![]() ,氢离子移动向阴极,当转移4mole-时,阳极电解质溶液减少2mol水,则每转移1mole-时,阳极电解质溶液减少0.5mol水,质量为9g,故C错误;
,氢离子移动向阴极,当转移4mole-时,阳极电解质溶液减少2mol水,则每转移1mole-时,阳极电解质溶液减少0.5mol水,质量为9g,故C错误;
D. 阳极发生反应![]() ,氢离子移动向阴极,则反应结束后阳极区硫酸浓度会增大,pH减小,故D错误;
,氢离子移动向阴极,则反应结束后阳极区硫酸浓度会增大,pH减小,故D错误;
故选AB。

 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】参考下列图表和有关要求回答问题:
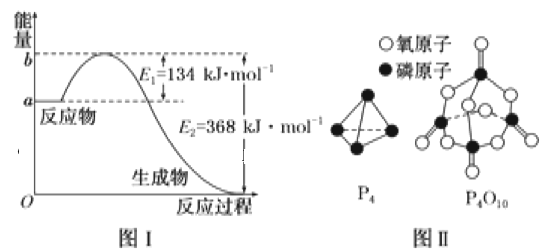
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是__(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
已知1mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=__kJ·mol-1。
(3)PCl5是一种重要的含磷化合物,在有机合成中用作氯化剂。某温度时,向2.0L恒温恒容密闭容器中充入1.0molPCl5,发生反应PCl5(g)![]() PCl3(g)+C12(g)ΔH=+124kJ·mol-1。反应过程中测定的部分数据见下表:
PCl3(g)+C12(g)ΔH=+124kJ·mol-1。反应过程中测定的部分数据见下表:
时间t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
反应在前50s的平均速率v(PCl5)=__。在该温度下,若起始时充入0.5molPCl5和amolCl2,平衡时PCl5的转化率仍为20%,则a=__。