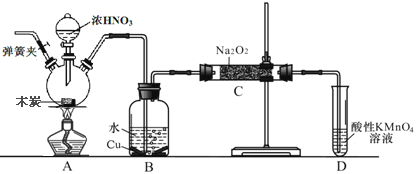
题目内容
【题目】下列说法正确的是( )
A.在100℃、101kPa条件下,液态水的气化热为40.69kJmol﹣1 , 则H2O(g)H2O(l)的△H=40.69kJmol﹣1
B.常温下,在0.10molL﹣1的NH3H2O溶液中加入少量NH4Cl晶体,能使NH3H2O的电离度降低,溶液的pH减小
C.已知:
共价键 | C﹣C | C=C | C﹣H | H﹣H |
键能/kJmol﹣1 | 348 | 610 | 413 | 436 |
则反应 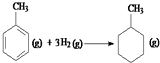 的焓变为△H=[(4×348+3×610+8×413)+3×436﹣(7×348+14×413)]kJmol﹣1=﹣384kJmol﹣1
的焓变为△H=[(4×348+3×610+8×413)+3×436﹣(7×348+14×413)]kJmol﹣1=﹣384kJmol﹣1
D.已知MgCO3的Ksp=6.82×10﹣6 , 则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32﹣),且c(Mg2+)c(CO32﹣)=6.82×10﹣6
【答案】B
【解析】解:A.气体转化为液体是放热过程,则正确的表达为:H2O(g)H2O(l)△H=﹣40.69kJmol﹣1,故A错误;
B.NH3H2O溶液中存在电离平衡,加入少量NH4Cl晶体,NH4+浓度增大使电离平衡向逆方向移动,电离程度降低,溶液的pH减小,故B正确;
C.因为苯环中的碳碳键是介于单双键之间的一种独特的键,不存在典型的碳碳双键和碳碳单键,不能用以上表中进行计算,故C错误;
D.含有固体MgCO3的溶液中,是饱和溶液,Mg2+离子和CO32﹣离子都能水解,水解后离子浓度可能不相等,但在相同的温度下,溶度积常数不变,故D错误;
故选B.
【考点精析】认真审题,首先需要了解弱电解质在水溶液中的电离平衡(当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理).