题目内容
用惰性电极电解50 mL锰酸钾溶液:K2MnO4+H2O→KMnO4+H2↑+KOH(未配平),当生成112 mL氢气(标准状况)时停止通电。下列判断正确的是 ( )
| A.K+浓度减小 | B.KMnO4在阳极区生成 |
| C.阴极周围溶液的pH减小 | D.反应过程中共转移0.005mol电子 |
B
试题分析:A.反应方程式为:2K2MnO4+2H2O=2KMnO4+H2↑+2KOH。在反应过程中K+没有发生反应,所以浓度,消耗了水,所以K+的浓度增大。错误。B. MnO42-→MnO4-.失去电子,发生氧化反应。根据电解原理:阳极发生氧化反应,阴极发生还原反应。所以KMnO4在阳极区生成。正确。C.阴极放出氢气,破坏了附近的水的电离平衡,导致附近溶液中的OH-的浓度增大,周围溶液的pH增大。错误。在反应中每产生1mol的氢气转移电子2mol.现在产生氢气n(H2)=0.112L÷22.4mol/L=0.005mol.所以转移电子0.01mol.错误。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
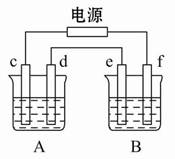
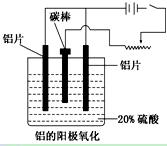
 4Al+3O2↑
4Al+3O2↑ Cu+Cl2↑
Cu+Cl2↑