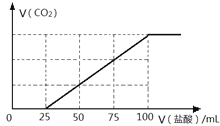
题目内容
【题目】工业制硫酸铜的方法很多:
(1)方法一:用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_______________________。
(2)方法二:实验证明,铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的。铜屑在此状态下被溶解的化学方程式为_____________________________。
(3)以上两种方法________(填“前”或“后”)者好,原因是________________________。
(4)方法三:用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
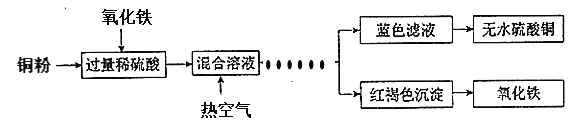
稀硫酸和氧化铁反应的离子方程式是_____________________________(反应①);铜和上述反应(反应①)得到的物质反应的离子方程式是_________________________;向混合溶液中通入热空气的目的是_______________________________;分离蓝色滤液和红褐色沉淀的实验操作是_________。
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 2Cu+2H2SO4(稀)+O2
CuSO4+SO2↑+2H2O 2Cu+2H2SO4(稀)+O2![]() 2CuSO4+2H2O 后 若制得1mol CuSO4,第一种方法需2mol H2SO4,而第二种方法只需要1mol H2SO4,而且第一种方法生成的SO2又造成大气污染 Fe2O3+6H+=2Fe3++3H2O 2Fe3++Cu=2Fe2++Cu2+ 把Fe2+氧化成Fe3+ 过滤
2CuSO4+2H2O 后 若制得1mol CuSO4,第一种方法需2mol H2SO4,而第二种方法只需要1mol H2SO4,而且第一种方法生成的SO2又造成大气污染 Fe2O3+6H+=2Fe3++3H2O 2Fe3++Cu=2Fe2++Cu2+ 把Fe2+氧化成Fe3+ 过滤
【解析】
本题考查的是浓硫酸的性质、铜金属及其重要化合物的主要性质、制备实验方案的设计。
(1)铜与浓硫酸反应生成硫酸铜、二氧化硫和水;
(2)铜与稀硫酸、氧气反应生成硫酸铜和水;
(3)依据生成物性质及消耗硫酸的量解答,从安全、节约、环保等方面进行评价判断选择制备硫酸铜的方法;
(4)依据流程图分析判断,稀硫酸、铜和氧化铁反应是氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁和铜反应生成氯化亚铁和氯化铜;通入热的空气是为了氧化亚铁离子为三价铁离子,调整溶液pH除去铁离子;溶液中得到溶质固体的方法是蒸发水结晶析出。
(1)铜和浓硫酸加热的条件下反应生成硫酸铜、二氧化硫和水。反应方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。本小题答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O。本小题答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(2)将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液,化学反应方程式为:2Cu+2H2SO4(稀)+O2![]() 2CuSO4+2H2O。本小题答案为:2Cu+2H2SO4(稀)+O2
2CuSO4+2H2O。本小题答案为:2Cu+2H2SO4(稀)+O2![]() 2CuSO4+2H2O;
2CuSO4+2H2O;
(3)第一种方法生成1mol硫酸铜消耗2mol浓硫酸,同时生成有毒的气体二氧化硫;第二种方法,生成1mol硫酸铜消耗1mol稀硫酸,反应过程中无有毒气体产生,所以从环境保护和节约原料角度可知后者更好。本小题答案为:后;若制得1mol CuSO4,第一种方法需2mol 浓H2SO4,而第二种方法只需要1mol稀 H2SO4,而且第一种方法生成的SO2又造成大气污染。
(4)依据流程转化图分析,铜需要硫酸和氧化铁反应生成的铁离子溶解生成铜离子,再通入空气氧化亚铁离子为铁离子,调节溶液pH使铁离子沉淀除去,得到硫酸铜溶液;加热蒸发浓缩结晶得到硫酸铜晶体。反应的离子方程式为:Fe2O3+6H+═2Fe3++3H2O、2Fe3++Cu═2Fe2++Cu2+;通入空气的作用是氧气把亚铁离子氧化为铁离子;分离蓝色滤液和红褐色沉淀的实验操作是过滤。本小题答案为:Fe2O3+6H+=2Fe3++3H2O; 2Fe3++Cu=2Fe2++Cu2+;把Fe2+氧化成Fe3+;过滤。

【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式:_______;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
,请写出此反应的热化学方程式:_______;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=______,该条件下的平衡常数K=________。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”“逆向”或“不”);最终达平衡时NO的转化率a=______________。
(3)在25 ℃下,向浓度均0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_____沉淀(填化学式),当两种沉淀共存时,溶液中c(Mg2+)/c(Cu2+)=__________(已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
【题目】在如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细,由此判断下表中所列的M、N、P物质,其中可以成立的是
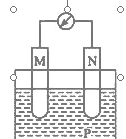
选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸银溶液 |
A. A B. B C. C D. D