题目内容
3.将pH=11NaOH溶液和pH=3的醋酸溶液以等体积混合后,对所得溶液,下列判断一定正确的是( )| A. | c(CH3COO-)<c(Na+) | B. | c(CH3COO-)>c(Na+) | C. | c(OH-)=c(CH3COO-) | D. | c(OH-)>c(CH3COO-) |
分析 醋酸为弱电解质,溶液中部分电离,pH=3的醋酸溶液溶液中氢离子浓度为0.001mol/L,则醋酸的浓度一定大于0.001mol/L;pH=11NaOH溶液中氢氧化钠的浓度为0.001mol/L,两溶液等体积混合后醋酸过量,溶液显示酸性,然后根据电荷守恒判断溶液中各离子浓度大小.
解答 解:由于醋酸为弱酸,pH=11NaOH溶液和pH=3的醋酸溶液以等体积混合后,醋酸过量,反应后的溶液为酸性溶液,则c(H+)>c(OH-),
A.根据电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),由于c(H+)>c(OH-),则c(CH3COO-)>c(Na+),故A错误;
B.根据反应后的溶液中电荷守恒及溶液显示酸性可知,c(CH3COO-)>c(Na+),故B正确;
C.反应后的溶液为酸性溶液,溶液中氢氧根离子浓度很小,所以c(OH-)<c(CH3COO-),故C错误;
D.反应后溶液为酸性溶液,氢氧根离子浓度远远小于醋酸根离子浓度,即c(OH-)<c(CH3COO-),故D错误;
故选B.
点评 本题考查了溶液中离子浓度大小比较,题目难度中等,明确弱电解质部分电离及溶液酸碱性与pH的关系是解题关键,注意掌握电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 一切物质中均有化学键 | |
| B. | 离子化合物中可能含有极性键,共价化合物中不可能含有离子键 | |
| C. | 只由共价键构成的物质一定为共价化合物 | |
| D. | 主族元素的最高正化合价都等于其最外层电子数 |
8.下列各组物质中都是由分子构成的化合物是( )
| A. | CO2、NO2、SiO2 | B. | HCl、NH3、CH4 | C. | NO、CO、CaO | D. | O2、N2、Cl2 |
15.A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数为( )
①a-4 ②a-5 ③a+3 ④a+4.
①a-4 ②a-5 ③a+3 ④a+4.
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
13.下列关于SO2的说法中,正确的是( )
| A. | 该物质属于混合物 | B. | 硫元素的化合价为+2 | ||
| C. | 化学名称是二氧化硫 | D. | 硫元素和氧元素的质量比为1:2 |
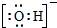 .
.