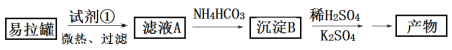题目内容
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:

(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42=2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示。
NaHPbO2(aq),其溶解度曲线如图所示。

①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是____._(选填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用氢氧化钠,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过滤Ⅲ的目的是提纯,综合上述溶解度曲线,简述过程Ⅲ的操作_______________________。
【答案】(1)Pb + PbO2 + 2H2SO4![]() 2PbSO4+ 2H2O。
2PbSO4+ 2H2O。
(2)①2Fe3++Pb+SO42—==PbSO4+2Fe2+;
②取a中红色溶液少量,加入过量Pb,充分反应后,红色褪去。
(3)①A、B;②将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃,充分溶解后,趁热过滤,冷却结晶,过滤、洗涤并干燥得到PbO固体。
【解析】(1)根据题给化学工艺流程知,过程Ⅰ中,在Fe2+催化下,Pb、PbO2和H2SO4反应生成PbSO4和水,化学方程式为Pb + PbO2 + 2H2SO4![]() 2PbSO4+ 2H2O。
2PbSO4+ 2H2O。
(2)①催化剂通过参加反应,改变反应历程,降低反应的活化能,加快化学反应速率,而本身的质量和化学性质反应前后保持不变。根据题给信息知反应i中Fe2+被PbO2氧化为Fe3+,则反应ii中Fe3+被Pb还原为Fe2+,离子方程式为2Fe3++Pb+SO42—==PbSO4+2Fe2+;
②a实验证明发生反应i,则b实验需证明发生反应ii,实验方案为取a中红色溶液少量,加入过量Pb,充分反应后,红色褪去。
(3)①过程Ⅱ脱硫过程中发生的反应为PbSO4+2NaOH==PbO+Na2SO4+H2O,而滤液Ⅰ中含有硫酸,可降低溶液的pH,使平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)逆向移动,减少PbO的损失,提高产品的产率,同时重复利用NaOH,提高原料的利用率答案选AB;
NaHPbO2(aq)逆向移动,减少PbO的损失,提高产品的产率,同时重复利用NaOH,提高原料的利用率答案选AB;
②根据PbO的溶解度曲线,提纯粗Pb的方法为将粗PbO溶解在35%NaOH溶液中配成高温下的饱和溶液,降温结晶、过滤,洗涤并干燥即可得到PbO。