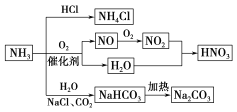
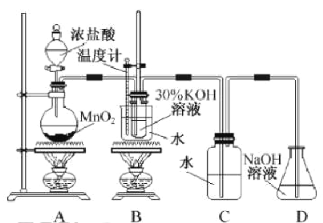
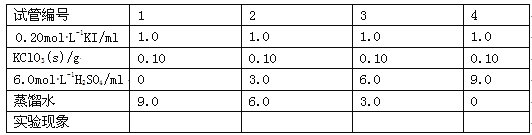
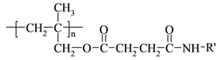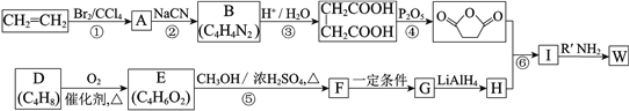题目内容
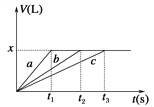
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则x值为( )(要求写出解答过程)
A. 1.12 B. 4.48
C. 2.24 D. 无法确定
【答案】C
【解析】由于最后生成的气体量相同,所以这些金属置换出的氢气量相等,即等物质的量的三种金属失去了相同数量的电子,而若盐酸过量的话,这些金属失去的电子数因该是不一样的,比值应是1:2:3,故推断出盐酸不可能过量,但可能刚好和Na反应完全,此时Na完全反应而Mg、Al还有剩余,由于酸不足,所以生成氢气的量为:n(H2)=![]() ,所以标况下的体积为2.24L,故C正确;故选C。
,所以标况下的体积为2.24L,故C正确;故选C。

练习册系列答案
相关题目