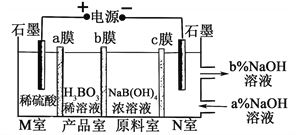
��Ŀ����
����Ŀ����ͼ��ʾ3��ʵ��װ�ã��ֱ�ش��������⡣
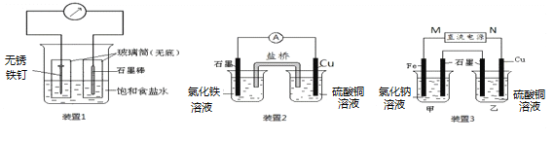
��1��װ��1Ϊ����������ʴʵ�顣һ��ʱ��������̼���IJ���Ͳ�ڵ����̪��Һ���ɹ۲쵽̼����������Һ��죬�õ缫��ӦΪ_________________��
��2��װ��2�е�ʯī�Ǽ�________�����������������װ�÷������ܷ�Ӧ�����ӷ���ʽΪ________________________��
��3��װ��3�м��ձ�ʢ��100 mL 0.2 mol/L��NaCl��Һ�����ձ�ʢ��100 mL 0.5 mol/L��CuSO4��Һ����Ӧһ��ʱ���ֹͣͨ�硣����ձ��е��뼸�η�̪��Һ���۲쵽ʯī�缫�������ȱ�졣
�� ��Դ��M��Ϊ��____________������������������ձ������缫�ĵ缫��ӦΪ__________��
�� ���ձ��е�ⷴӦ�Ļ�ѧ����ʽΪ___________________________��
�� ֹͣ��⣬ȡ��Cu�缫��ϴ�ӡ�����������缫���� 0.64 g�����ձ��в����������״�������Ϊ___________mL��
���𰸡���1��O2+4e��+2H2O=4OH����
��2������Fe3��+Cu=2Fe2��+Cu2��
��3��������Fe-2e��=Fe2����2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4��224
2Cu+O2��+2H2SO4��224
��������
�����������1��װ��1Ϊ����������ʴ����������������ʧȥ���ӵ�������Ӧ��ʯī�缫��������O2��ʯī�缫�Ϸ����õ����ӵĻ�ԭ��Ӧ������OH�����缫��ӦʽΪO2+ 4e��+ 2H2O = 4OH������2��װ��2�У�Cu�缫Ϊ����������ʧȥ���ӵ�������Ӧ������Cu2����ʯī�缫Ϊ������Fe3���ڸõ缫�Ϸ����õ����ӵĻ�ԭ��Ӧ������Fe2�����ܷ�Ӧ�����ӷ���ʽΪFe3�� + Cu = 2Fe2�� + Cu2������3��������ձ��е��뼸�η�̪��Һ���۲쵽ʯī�缫�������ȱ����˵����ʯī�缫�ϣ�ˮ�������H�������õ����ӵĻ�ԭ��Ӧ������H2��ʹʯī�缫����c(OH-)��c(H��)�����ʯī�缫Ϊ��������ʯī�缫������N��Ϊ��Դ��������M��Ϊ��Դ�����������ձ���Fe�����ص�����������ʧȥ���ӵ�������Ӧ���缫��ӦʽΪFe -2e��= Fe2���������ձ��У�ʯī�缫Ϊ���ص�������ˮ�������OH-����ʧȥ���ӵ�������Ӧ������O2��Cu�缫�����ص���������Cu�缫�ϣ�Cu2�������õ����ӵĻ�ԭ��Ӧ������Cu���ʣ�����ܵĵ�ⷴӦʽΪ2CuSO4+ 2H2O![]() 2Cu + O2�� + 2H2SO4�������ձ�������Cu���ʵĵ缫��ӦΪCu2��+2e��=Cu����������Cu������Ϊ0.64g����ת�Ƶ��ӵ����ʵ���Ϊ
2Cu + O2�� + 2H2SO4�������ձ�������Cu���ʵĵ缫��ӦΪCu2��+2e��=Cu����������Cu������Ϊ0.64g����ת�Ƶ��ӵ����ʵ���Ϊ![]() �����ձ��в�������ĵ缫��ӦʽΪ2Cl����2e��= Cl2������Cl2�����ʵ���Ϊ
�����ձ��в�������ĵ缫��ӦʽΪ2Cl����2e��= Cl2������Cl2�����ʵ���Ϊ![]() ���ڱ�״���µ����Ϊ
���ڱ�״���µ����Ϊ![]() ��
��

 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д� Сѧ��ĩ���Ծ�ϵ�д�
Сѧ��ĩ���Ծ�ϵ�д�����Ŀ������/H2O2��Һ����������������������
(1)��֪T��ʱ��2SO2(g)+O2(g) ![]() 2SO3(g) ��H1
2SO3(g) ��H1
2H2O2(I)=2H2O(I)+O2(g) ��H2
SO3(g)+H2O(I))=H2SO4(I) ��H3
��SO2(g)+H2O2(I))=H2SO4(I) ��H4=__________ (�ú���H1����H2����H3�Ĵ���ʽ��ʾ)
(2)����[CO(NH2)2]��Һ��NOx��SO2��һ�����ѳ��ʡ���SO2��NOx (N��Լռ90%)ͨ���������������Ϊ7%������Ũ��Ϊ5%�ķ�Ӧ���н��з�Ӧ��
��������SO2����ת��Ϊһ�����Σ��仯ѧʽΪ______________��NO��NO2�����ʵ���֮��1:1��CO(NH2)2��Ӧ����������Ļ�ѧ����ʽΪ_______________��
�ڰ��������(H2NCOONH4)�����ص�ˮ������һ�����İ�����������ں����ܱ������У�������Ӧ��NH2COONH4(s)![]() 2NH3(g)��CO2(g) ��H��ʵ���ò�ͬ�¶���ƽ��ʱ�������Ũ�����±���
2NH3(g)��CO2(g) ��H��ʵ���ò�ͬ�¶���ƽ��ʱ�������Ũ�����±���
�¶�/K | 338 | 343 | 348 | 353 |
ƽ��ʱ�������Ũ��/mol L-1 | 0.36 | 0.48 | 0.60 | 0.72 |
�÷�Ӧ�ġ�H__________(�>����<��)0��348Kʱ���÷�Ӧ��ƽ�ⳣ��K__________________��
(3)�����������䣬��������Һ������H2O2��Һ����ò�ͬ pH�µ���������ѳ�����ʱ��Ĺ�ϵ��ͼ��ʾ��

��NO��H2O2������Ӧ����������ʱ���������뻹ԭ�������ʵ���֮��Ϊ____________��
(2)����ʱ�����pHΪ_________���ڼ��Խ�ǿʱ��NOx�ѳ��ʽ��ͣ���ԭ����___________(��дһ��)��