题目内容
以下有关物质的质量分数和物质的量浓度的叙述正确的是
| A.等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成硫酸钡沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度之比为1:1:1 |
| B.Na2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等 |
| C.质量分数分别为5%和15%的氨水等体积混合后所得溶液的质量分数为10% |
D.20℃时,饱和KCl溶液的密度为1.174g?cm-3,物质的量浓度为4.0 mol?L-1,则此溶液中KCl的质量分数为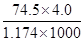 ×100% ×100% |
D
解析试题分析:A项,由生成硫酸钡沉淀的质量相等,即生成硫酸钡的物质的量相等,说明各溶液中含有相量物质的量的SO42-,设溶液中含有的物质的为1 mol,则有Fe2(SO4)3 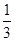 mol、CuSO41 mol、K2SO41 mol,故浓度之比为
mol、CuSO41 mol、K2SO41 mol,故浓度之比为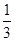 : 1 : 1="1" : 3 : 3,A项错误。B项,Na2O2和Na2O各0.1mol分别放入100g水中,所得溶液的体积不相同,则物质的量浓度不相等,B项错误。C项中,若两种氨水等体积混合,浓的密度较小,所以质量较小,两种氨水混合后,质量分数更接近稀氨水的浓度,所得氨水溶液的质量分数小于10%,C项错。20℃时,饱和KCl溶液的密度为1.174g?cm-3,物质的量浓度为4.0mol?L-1,根据c=
: 1 : 1="1" : 3 : 3,A项错误。B项,Na2O2和Na2O各0.1mol分别放入100g水中,所得溶液的体积不相同,则物质的量浓度不相等,B项错误。C项中,若两种氨水等体积混合,浓的密度较小,所以质量较小,两种氨水混合后,质量分数更接近稀氨水的浓度,所得氨水溶液的质量分数小于10%,C项错。20℃时,饱和KCl溶液的密度为1.174g?cm-3,物质的量浓度为4.0mol?L-1,根据c= 可知,质量分数为w=
可知,质量分数为w=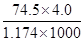 ×100%,故D正确;
×100%,故D正确;
考点:物质的量浓度

练习册系列答案
 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为
| A.0.1(b-2a)mol/L | B.10(2a-b)mol/L | C.10(b-a)mol/L | D.10(b-2a)mol/L |
下列溶液中含Cl—的物质的量浓度最大的是( )
| A.50mL0.5mol/LKCl溶液 | B.200mL0.3mol/LMgCl2溶液 |
| C.100mL0.25mol/LAlCl3溶液 | D.500mL0.5mol/LHCl溶液 |
用NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.标准状况下,22.4LCCl4含有NA个分子 |
| B.常温常压下46gNO2和N2O4混合气体含有3NA个原子 |
| C.0.1molAlCl3完全转化为氢氧化铝胶体,生成0.l NA个胶体粒子 |
| D.0.1molCl2与足量NaOH溶液反应,转移电子数为0.2 NA |
标况下有以下四种气体:①6.72LCH4 ②3.01×1023个HCl分子 ③13.6克H2S ④0.2molNH3。下列对四种气体的关系从小到大表示不正确的是( )
| A.体积:④<①<③<② | B.质量: ④<①<③<② |
| C.物质的量:①<②<③<④ | D.氢原子数: ②<④<③<① |
当0.2molNa218O2足量CO2完全反应后所得固体的质量为( )
| A.21.2g | B.21.6g | C.22.0g | D.22.4g |
下列化学用语正确的是( )
| A.CaH2的电子式:[H:]_Ca2+[:H]- | B.铝离子的结构示意图: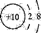 |
C.CO2的比例模型: | D.核内有8个中子的碳原子: |
下列有关化学用语表示正确的是( )
A.乙炔的电子式: |
B.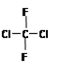 和 和 是同一物质 是同一物质 |
C.对甲基苯甲醇的结构简式: |
D.乙醇分子的比例模型: |