题目内容
标况下有以下四种气体:①6.72LCH4 ②3.01×1023个HCl分子 ③13.6克H2S ④0.2molNH3。下列对四种气体的关系从小到大表示不正确的是( )
| A.体积:④<①<③<② | B.质量: ④<①<③<② |
| C.物质的量:①<②<③<④ | D.氢原子数: ②<④<③<① |
C
解析试题分析:各种气体的物质的量是①0.3mol.②0.5mol.③0.4mol. ④ 0.2mol物质的量关系是:②>③>①>④ 。在相同的外界条件下,气体的物质的量越多,气体的体积越大。气体的体积关系是: ④<①<③<② 。 各种气体的质量是m=n·M ①0.3mol×16g/mol=4.8g.②0.5mol×36.5g/mol=18.25g.③0.4mol×34g/mol="13.6g." ④ 0.2mol×17g/mol=3.4g 所以质量关系是④<①<③<②。氢原子数:①0.3×5NA=1.5NA.②0.5×2NA=NA.③0.4×3NA=1.2NA.. ④ 0.2×4NA=0.8NA.氢原子数关系是: ②<④<③<①
考点:考查物质的量的有关计算的知识。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案NA为阿伏加德罗常数,下列叙述正确的是
| A.10 g H218O含有的中子数为5NA |
| B.1 mol羟基(-OH)含有的电子数为10NA |
| C.1 mol 氯气参加反应时,电子转移数目一定为2NA |
| D.标准状况下,11.2L己烷含有的分子数为0.5 NA |
用NaHCO3和KHCO3组成的混合物分别与三份同浓度的盐酸进行反应,测得数据如下:
则下列结论中不正确的是 ( )
| A.盐酸物质的量浓度为1.5 mol/L, |
| B.15.7g混合物与盐酸反应后有剩余 |
| C.加入9.2 g混合物时消耗HCl 0.1 mol |
| D.混合物中NaHCO3和KHCO3的质量比为1 :1 |
以下有关物质的质量分数和物质的量浓度的叙述正确的是
| A.等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成硫酸钡沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度之比为1:1:1 |
| B.Na2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等 |
| C.质量分数分别为5%和15%的氨水等体积混合后所得溶液的质量分数为10% |
D.20℃时,饱和KCl溶液的密度为1.174g?cm-3,物质的量浓度为4.0 mol?L-1,则此溶液中KCl的质量分数为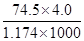 ×100% ×100% |
若NA表示阿伏加德罗常数,下列说法正确的是( )
| A.标准状况下,120g二氧化硅固体中,含有2NA个二氧化硅分子 |
| B.标准状况下,18g重水含有10NA个中子 |
| C.室温下, 46克二氧化氮与四氧化二氮混合气体中原子数是3NA |
| D.常温常压下,过氧化钠与过量水反应,生成0.2摩氧气,转移电子0.2NA |
现有Fe、FeO、Fe2O3和Fe3O4组成的混合物,取一定质量,加入100 mL 4 mol/L的盐酸,混合物恰好完全溶解,放出a mL(标准状况下)的气体,所得溶液中加入KSCN溶液无血红色出现。若取等质量的该混合物,用足量的CO还原可得铁单质的质量为
| A.2.8g | B.5.6g | C.8.4g | D.11.2 g |
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相等(不考虑水解),且SO42-的物质的量浓度为9mol/L,则此溶液最多溶解Mg的质量为 ( )
| A.24g | B.18g | C.21.6g | D.14.4g |
设NA为阿伏加德罗常数值,下列说法不正确的是( )
| A.标准状况下,22.4L任何气体都约含有6.02×1023个分子 |
| B.同温、同压下,相同体积的氟气和氩气所含的原子数相等 |
| C.18g D2O含有的电子数为9NA |
| D.2.4g金属镁与CO2完全反应时失去的电子数目为0.2NA |