题目内容
用NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.标准状况下,22.4LCCl4含有NA个分子 |
| B.常温常压下46gNO2和N2O4混合气体含有3NA个原子 |
| C.0.1molAlCl3完全转化为氢氧化铝胶体,生成0.l NA个胶体粒子 |
| D.0.1molCl2与足量NaOH溶液反应,转移电子数为0.2 NA |
B
解析试题分析:A、标况下CCl4为液态,错误;B、正确;C、胶体粒子是许多氢氧化铁聚集的颗粒,故生成的胶体粒子小于0.l NA,错误;D、氯气发生歧化反应,一半做氧化剂一半做还原剂,转移的电子数为0.l NA,错误。
考点:考查阿伏加德罗常数有关问题。

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
用nA表示阿伏加德罗常数的数值,下列叙述正确的是
| A.常温常压下,200 g 8.5%的H2O2水溶液中含氧原子总数为nA |
| B.标准状况下,22.4LCHCI3中含C -H键数目为nA |
| C.常温下,14g丙烯(CH3CH=CH2)中含碳原子数为nA |
| D.常温下,pH=13的氢氧化钠溶液中,含OH一数目为nA |
实验室用NaCl固体配400 mL 1.0 mol/L NaCl溶液,下列判断不对的是( )
| A.用托盘天平称取NaCl固体23.4 g |
| B.应选用500 mL的容量瓶来配制此溶液 |
| C.在转移操作中不慎将溶液洒到容量瓶外面,应该重新配置溶液 |
| D.加蒸馏水至离刻度线1-2 cm时改用胶头滴管定容 |
a L Al2(SO4)3溶液中含有Al3+为b mol,则该溶液里SO42-的物质的量浓度为
| A.3b/2a | B.2b/3a | C.2b/a | D.3b/a |
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A.1 molCl2与足量Fe反应转移电子数一定为3NA |
| B.标准状况下,2.24 L NH3中含有共价键的数目为NA |
| C.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
| D.标况下,11.2 L HF所含的分子数目为0.5NA |
以下有关物质的质量分数和物质的量浓度的叙述正确的是
| A.等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成硫酸钡沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度之比为1:1:1 |
| B.Na2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等 |
| C.质量分数分别为5%和15%的氨水等体积混合后所得溶液的质量分数为10% |
D.20℃时,饱和KCl溶液的密度为1.174g?cm-3,物质的量浓度为4.0 mol?L-1,则此溶液中KCl的质量分数为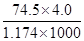 ×100% ×100% |
同温同压下,两个容积相等的储气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶内气体一定具有相同的( )
| A.质量 | B.原子总数 | C.碳原子数 | D.密度 |
有FeO、Fe2O3的混合物若干克,在足量H2气流中,加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解,需1mol?L﹣1的盐酸的体积至少为( )
| A.0.05 L | B.0.1 L | C.0.2 L | D.1 L |
同温同压下,等质量的下列气体所占有的体积最大的是( )
| A.CH4 | B.O2 | C.CO2 | D.SO2 |