题目内容
某探究性学习小组用如图所示的装置和药品探究Cl2的化学性质: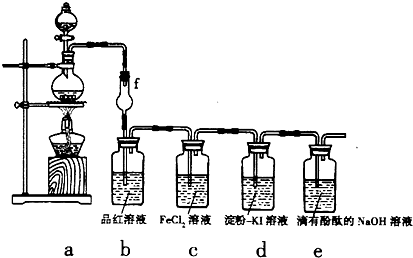
试回答下列问题:
(1)用图中a装置来制取Cl2,则浓盐酸应放入a装置的______(填仪器名称)中.
(2)该实验方案存在的主要缺陷是______.
(3)①当a中产生足量氯气时,b装置内的现象为______,f装置的作用是______.
②c装置内溶液由浅绿色变为黄色,为检验c装置内生成的阳离子,某同学进行了如下实验:向反应后的溶液中先滴加KSCN溶液,溶液呈血红色,再向其中滴加过量的新制氯水时,发现溶液的血红色褪去.为了弄清溶液血红色褪去的原因,同学们查到如下资料:
Ⅰ.铁元素可形成铁酸盐(含有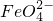 );
);
Ⅱ.SCN-的电子式为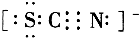 ;
;
Ⅲ.氯水具有很强的氧化性.
于是同学们提出以下两种假设:
假设一:Cl2可将Fe3+氧化成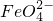 ,请写出该反应的离子方程式:______.
,请写出该反应的离子方程式:______.
假设二:______,提出该假设的理论依据是______.欲探究上述假设是否成立,可设计的实验方案为______.
解:(1)实验室制取氯气时用浓盐酸和二氧化锰,因此需将浓盐酸盛放在易控制流量的分液漏斗中,故答案为:分液漏斗;
(2)氯气有毒,不能直接排空,会污染大气,所以要有尾气处理装置,故答案为:缺少尾气处理装置,易造成大气污染;
(3)①氯气和水反应生成次氯酸,次氯酸有漂白性,所以溶液由红色变为无色;导致的干燥管有缓冲作用,所以能防止倒吸,故答案为:溶液由红色变为无色,防止倒吸;
②假设一 氯气将铁离子氧化生成高铁酸根离子,自身被还原生成氯离子,所以离子反应方程式为:2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+;
假设二 硫氰根离子被氯气氧化,由硫氰根离子的电子式可知,S、N元素处于最低价态,所以硫氰根离子具有强还原性,能被氯气氧化;
欲探究上述假设是否成立,可设计的实验方案为:向褪色后的溶液中加入适量的硫氰化钾溶液,若溶液恢复血红色,则假设二成立,若溶液不恢复血红色,则假设一成立,
故答案为:2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+;硫氰根离子被氯气氧化;硫氰根离子中硫、氮元素处于最低价态;向褪色后的溶液中加入适量的硫氰化钾溶液,若溶液恢复血红色,则假设二成立,若溶液不恢复血红色,则假设一成立.
分析:(1)实验室用分液漏斗盛放浓盐酸;
(2)氯气有毒,不能直接排空;
(3)①次氯酸能使品红溶液褪色,导致的干燥管有缓冲作用;
②氯气将铁离子氧化生成高铁酸根离子,自身被还原生成氯离子;
硫氰根离子被氯气氧化,根据硫氰根离子中硫、氮元素的化合价判断其性质,向褪色后的溶液中进行反滴,根据溶液是否恢复原色来判断假设.
点评:本题考查探究氯气的化学性质,氯气有强氧化性,能氧化还原性的物质,难点是实验方案的设计,根据物质的性质来进行实验方案设计,结合资料信息解答,难度中等.
(2)氯气有毒,不能直接排空,会污染大气,所以要有尾气处理装置,故答案为:缺少尾气处理装置,易造成大气污染;
(3)①氯气和水反应生成次氯酸,次氯酸有漂白性,所以溶液由红色变为无色;导致的干燥管有缓冲作用,所以能防止倒吸,故答案为:溶液由红色变为无色,防止倒吸;
②假设一 氯气将铁离子氧化生成高铁酸根离子,自身被还原生成氯离子,所以离子反应方程式为:2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+;
假设二 硫氰根离子被氯气氧化,由硫氰根离子的电子式可知,S、N元素处于最低价态,所以硫氰根离子具有强还原性,能被氯气氧化;
欲探究上述假设是否成立,可设计的实验方案为:向褪色后的溶液中加入适量的硫氰化钾溶液,若溶液恢复血红色,则假设二成立,若溶液不恢复血红色,则假设一成立,
故答案为:2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+;硫氰根离子被氯气氧化;硫氰根离子中硫、氮元素处于最低价态;向褪色后的溶液中加入适量的硫氰化钾溶液,若溶液恢复血红色,则假设二成立,若溶液不恢复血红色,则假设一成立.
分析:(1)实验室用分液漏斗盛放浓盐酸;
(2)氯气有毒,不能直接排空;
(3)①次氯酸能使品红溶液褪色,导致的干燥管有缓冲作用;
②氯气将铁离子氧化生成高铁酸根离子,自身被还原生成氯离子;
硫氰根离子被氯气氧化,根据硫氰根离子中硫、氮元素的化合价判断其性质,向褪色后的溶液中进行反滴,根据溶液是否恢复原色来判断假设.
点评:本题考查探究氯气的化学性质,氯气有强氧化性,能氧化还原性的物质,难点是实验方案的设计,根据物质的性质来进行实验方案设计,结合资料信息解答,难度中等.

练习册系列答案
相关题目
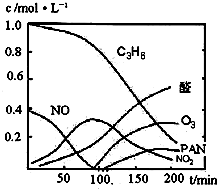 汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线.结合曲线,试回答下列问题.
汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线.结合曲线,试回答下列问题.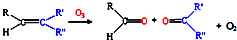 ,写出丙烯与臭氧作用生成醛的化学方程式(并配平)
,写出丙烯与臭氧作用生成醛的化学方程式(并配平)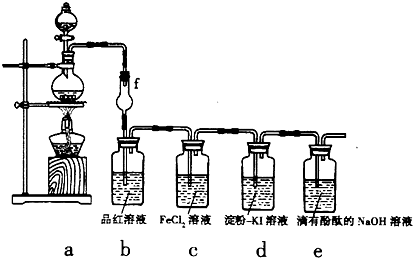
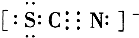 ;
;