题目内容
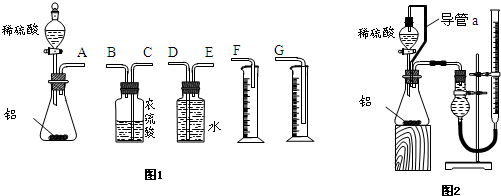
某中学探究性学习小组用如图所示的装置进行实验,在室温和1标准大气压强下,测得 ag含Al 96%的样品甲与稀硫酸完全反应产生的气体体积为bL。现欲在相同条件下,测定某一样品乙中Al的质量分数(样品甲、乙中的杂质均不与稀硫酸反应)。请回答下列问题:

(1)Al与稀硫酸反应的化学方程式为______。
(2)根据装置图,连接好装置,检查装置的气密性,加入药品后使反应开始发生的操作是____________。
(3)本实验中测量气体体积时应注意的事项有________________________。
(4)如果铝样品乙的质量为cg,测得气体的体积为dL,则铝样品乙中Al的质量分数计算式w(Al)=_______。
(2)根据装置图,连接好装置,检查装置的气密性,加入药品后使反应开始发生的操作是____________。
(3)本实验中测量气体体积时应注意的事项有________________________。
(4)如果铝样品乙的质量为cg,测得气体的体积为dL,则铝样品乙中Al的质量分数计算式w(Al)=_______。
(1)2Al+3H2SO4==Al2(SO4)3+3H2↑
(2)将三叉管向左倾斜,使稀硫酸与Al样品接触
(3)待装置内气体的温度恢复到室温后,调节量筒位置使其内外液面相平
(4)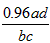
(2)将三叉管向左倾斜,使稀硫酸与Al样品接触
(3)待装置内气体的温度恢复到室温后,调节量筒位置使其内外液面相平
(4)

练习册系列答案
相关题目
某中学有甲、乙两个探究性学习小组,他们拟用小颗粒的铝铜合金与足量的稀硫酸反应测定通常状况(约20℃、1.01×105Pa)下的气体摩尔体积(Vm)。

(一)甲组同学拟设计如图1所示的装置来完成实验。
(1)写出装置I中发生反应的离子方程式: 。
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻旋开其活塞,一会儿后发现稀硫酸不能顺利滴入锥形瓶中。请帮助他们分析其原因: 。
(3)实验结束时,生成氢气的体积近似等于: 。
(4)锥形瓶中残存的氢气对实验结果是否有影响: (填“有”、“没有”、或“不能判断”),简述理由: 。
(二)乙组同学仔细分析了甲组同学的实验装置后以为,稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶中的空气排出,使所测氢气的体积偏大;实验结束后,连接广口瓶
和量筒的导管中有少量水存在,使所测氢气的体积偏小。于是他们设计了如图2所示的实验装置。
(1)装置中导管a的作用是: 。
(2)实验中准确测定出4个数据,如下表:
|
|
实验前 |
实验后 |
|
铝铜合金质量(g) |
m1 |
m2 |
|
量液管(C)体积(mL) |
V1 |
V2 |
利用上述数据计算通常状况下的气体摩尔体积:Vm= 。
 中学常见的某反应的化学方程式为A+B→C+D+H2O(未配平,反应条件略去).请回答下列有关问题.
中学常见的某反应的化学方程式为A+B→C+D+H2O(未配平,反应条件略去).请回答下列有关问题.