题目内容
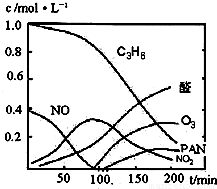
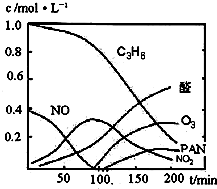
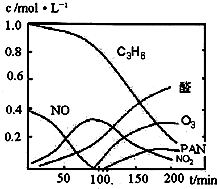 汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线.结合曲线,试回答下列问题.
汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线.结合曲线,试回答下列问题.(1)该烟雾箱实验可模拟下列哪种二次污染产生的机理
b
b
.(a)臭氧层破损坏 (b)光化学烟雾
(c)酸雨的形成 (d)白色污染
(2)0~100min内,平均反应速率最大的是:
NO
NO
(选填:C3H6、NO、NO2、醛、O3、PAN)(3)已知:
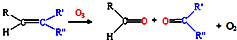 ,写出丙烯与臭氧作用生成醛的化学方程式(并配平)
,写出丙烯与臭氧作用生成醛的化学方程式(并配平)CH3CH=CH2+2O3→CH3CHO+HCHO+2O2
CH3CH=CH2+2O3→CH3CHO+HCHO+2O2
.(4)消除汽车尾气污染,喷NH3选择性催化还原是常用的一种方法.在950℃时喷NH3与NO反应而脱氮生成氮气,该反应的化学方程式为:
4NH3+6NO
5N2+6H2O
| ||
4NH3+6NO
5N2+6H2O
.
| ||
(5)2000K时,可以发生如下反应:
1/2N2+1/2O2?NO,K1
1/2N2+O2?NO2,K2
4NO?2NO2+N2,该反应的平衡常数K3=
| K22 |
| K14 |
| K22 |
| K14 |
分析:(1)能产生污染的气体为NO、NO2等,以此判断;
(2)判断曲线斜率,斜率最大的反应速率最大;
(3)丙烯与臭氧作用生成乙醛和甲醛;
(4)根据质量守恒判断NH3与NO反应生成氮气和水,以此书写方程式;
(5)已知①
N2+1/2O2?NO,K1; ②
N2+O2?NO2,K2,将②×2-①×4可得4NO?2NO2+N2.
(2)判断曲线斜率,斜率最大的反应速率最大;
(3)丙烯与臭氧作用生成乙醛和甲醛;
(4)根据质量守恒判断NH3与NO反应生成氮气和水,以此书写方程式;
(5)已知①
| 1 |
| 2 |
| 1 |
| 2 |
解答:解:(1)能产生污染的气体为NO、NO2,可导致光化学烟雾,故答案为:b;
(2)由图象可知反应斜率最大的为NO,则NO的反应速率最大,故答案为:NO;
(3)由题意可知丙烯与臭氧作用生成乙醛和甲醛,反应的方程式为CH3CH=CH2+2O3→CH3CHO+HCHO+2O2,故答案为:CH3CH=CH2+2O3→CH3CHO+HCHO+2O2;
(4)NH3与NO反应生成氮气和水,反应的方程式为4NH3+6NO
5N2+6H2O,故答案为:4NH3+6NO
5N2+6H2O;
(5)已知①
N2+1/2O2?NO,K1; ②
N2+O2?NO2,K2,将②×2-①×4可得4NO?2NO2+N2,则K3=
,故答案为:
.
(2)由图象可知反应斜率最大的为NO,则NO的反应速率最大,故答案为:NO;
(3)由题意可知丙烯与臭氧作用生成乙醛和甲醛,反应的方程式为CH3CH=CH2+2O3→CH3CHO+HCHO+2O2,故答案为:CH3CH=CH2+2O3→CH3CHO+HCHO+2O2;
(4)NH3与NO反应生成氮气和水,反应的方程式为4NH3+6NO
| ||
| ||
(5)已知①
| 1 |
| 2 |
| 1 |
| 2 |
| K22 |
| K14 |
| K22 |
| K14 |
点评:本题综合考查环境污染、化学反应速率以及化学平衡常数的计算等问题,注意根据题给信息结合质量守恒定律书写相关反应的化学方程式,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g); 9N2(g)+12CO2(g)+12H2O(g);
9N2(g)+12CO2(g)+12H2O(g);
 O2+Hb?CO K=220
O2+Hb?CO K=220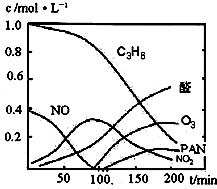 汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线.结合曲线,试回答下列问题.
汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线.结合曲线,试回答下列问题.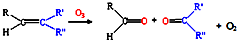 ,写出丙烯与臭氧作用生成醛的化学方程式(并配平)______.
,写出丙烯与臭氧作用生成醛的化学方程式(并配平)______.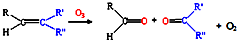
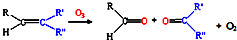 ,写出丙烯与臭氧作用生成醛的化学方程式(并配平)______.
,写出丙烯与臭氧作用生成醛的化学方程式(并配平)______.