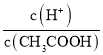题目内容
【题目】氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料.
(1)下表是当反应器中按![]() :
:![]() :3投料后,在
:3投料后,在![]() 、
、![]() 、
、![]() 下,反应达到平衡时,混合物中
下,反应达到平衡时,混合物中![]() 的物质的量分数随压强的变化曲线.
的物质的量分数随压强的变化曲线.
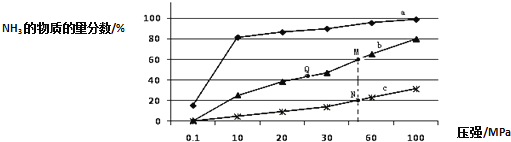
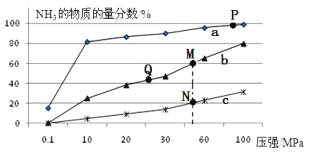
![]() 曲线a对应的温度是 ______ .
曲线a对应的温度是 ______ .
![]() 关于工业合成氨的反应,下列叙述正确的是 ______
关于工业合成氨的反应,下列叙述正确的是 ______ ![]() 填字母
填字母![]() .
.
A.及时分离出![]() 可以提高
可以提高![]() 的平衡转化率
的平衡转化率
B.加催化剂能加快反应速率且提高![]() 的平衡转化率
的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是![]()
![]() 点对应的
点对应的![]() 转化率是 ______ .
转化率是 ______ .
(2)工业制硫酸的尾气中含较多的![]() ,为防止污染空气,回收利用
,为防止污染空气,回收利用![]() ,工业上常用氨水吸收法处理尾气.
,工业上常用氨水吸收法处理尾气.
![]() 当氨水中所含氨的物质的量为3mol,吸收标准状况下
当氨水中所含氨的物质的量为3mol,吸收标准状况下![]()
![]() 时,溶液中的溶质为 ______ .
时,溶液中的溶质为 ______ .
![]() 溶液显酸性.用氨水吸收
溶液显酸性.用氨水吸收![]() ,吸收液显中性时,溶液中离子浓度关系正确的是 ______
,吸收液显中性时,溶液中离子浓度关系正确的是 ______ ![]() 填字母
填字母![]() .
.
![]()
![]()
![]()
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
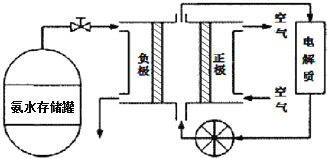
![]() 氨气燃料电池的电解质溶液最好选择 ______
氨气燃料电池的电解质溶液最好选择 ______ ![]() 填“酸性”、“碱性”或“中性”
填“酸性”、“碱性”或“中性”![]() 溶液.
溶液.
![]() 空气在进入电池装置前需要通过过滤器除去的气体是 ______ .
空气在进入电池装置前需要通过过滤器除去的气体是 ______ .
![]() 氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 ______ .
氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 ______ .
【答案】![]() AC
AC ![]()
![]() 和
和![]() ab 碱性
ab 碱性 ![]()
![]()
【解析】
![]() 合成氨反应放热,温度越低氨气的百分含量越高;
合成氨反应放热,温度越低氨气的百分含量越高;
![]() 、减小生成物浓度平衡正向移动;
、减小生成物浓度平衡正向移动;
B、催化剂不影响平衡移动;
C、K只受温度影响,该反应温度升高时K值减小;
![]() 利用
利用 求算;
求算;
![]() 氨的物质的量为3mol,吸收标准状况下
氨的物质的量为3mol,吸收标准状况下![]() 时.N原子3mol,S原子2mol,据原子守恒,在
时.N原子3mol,S原子2mol,据原子守恒,在![]() 中,其原子个数比N:
中,其原子个数比N:![]() :1,在中,
:1,在中,![]() ,其原子个数比N:
,其原子个数比N:![]() :1,据此分析;
:1,据此分析;
![]() 利用电荷守恒原理解答;
利用电荷守恒原理解答;
![]() 氨气是碱性气体;
氨气是碱性气体;
![]() 空气中的
空气中的![]() 能和氨水反应;
能和氨水反应;
![]() 正极发生氧化反应,氧气在正极反应,注意时碱性环境。
正极发生氧化反应,氧气在正极反应,注意时碱性环境。
![]() 合成氨反应放热,温度越低氨气的百分含量越高,所以,曲线a对应的温度是
合成氨反应放热,温度越低氨气的百分含量越高,所以,曲线a对应的温度是![]() ,
,
故答案为:![]() ;
;
![]() 、减小生成物浓度平衡正向移动,及时分离出
、减小生成物浓度平衡正向移动,及时分离出![]() 可以提高
可以提高![]() 的平衡转化率,故A正确;
的平衡转化率,故A正确;
B、催化剂不影响平衡移动,加催化剂能加快反应速率但不能提高![]() 的平衡转化率,故B错误;
的平衡转化率,故B错误;
C、K只受温度影响,该反应温度升高时K值减小,b是![]() ,c是
,c是![]() ,上图中M、N、Q点平衡常数K的大小关系是
,上图中M、N、Q点平衡常数K的大小关系是![]() ,故C正确;
,故C正确;
故答案选AC;
![]() 根据“三段式”计算可得:
根据“三段式”计算可得:
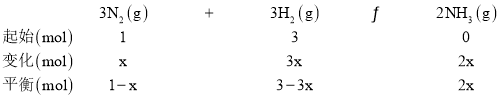
据题意M点时:![]() ,则
,则![]() ,
,
则氢气的转化率为: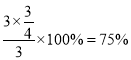 ,
,
故答案为:![]() ;
;
![]() 氨的物质的量为3mol,吸收标准状况下
氨的物质的量为3mol,吸收标准状况下![]() 时.N原子3mol,S原子2mol,据原子守恒,在
时.N原子3mol,S原子2mol,据原子守恒,在![]() 中,其原子个数比N:
中,其原子个数比N:![]() :1,在中,
:1,在中,![]() ,其原子个数比N:
,其原子个数比N:![]() :1,所以,生成物有
:1,所以,生成物有![]() 和
和![]() ,
,
故答案为:![]() 和
和![]() ;
;
![]() 据电荷守恒有:
据电荷守恒有:![]() ,溶液显中性,则,
,溶液显中性,则,![]() ,
,
故答案选:ab;
![]() 氨气是碱性气体,所以电解液最好选择碱性的,
氨气是碱性气体,所以电解液最好选择碱性的,
故答案为:碱性;
![]() 空气中的
空气中的![]() 能和氨水反应,所以,滤去的气体是
能和氨水反应,所以,滤去的气体是![]() ,
,
故答案为:![]() ;
;
![]() 正极发生氧化反应,氧气在正极反应,注意时碱性环境,所以,正极的电极反应式为:
正极发生氧化反应,氧气在正极反应,注意时碱性环境,所以,正极的电极反应式为:![]() ,
,
故答案为:![]() .
.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)