题目内容
【题目】常温下,向10mL0.1mol·L-1的HR溶液中逐滴滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析正确的是( )
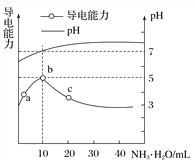
A. HR为强酸 B. a、b两点所示溶液中水的电离程度相同
C. b点溶液中c(NH![]() )>c(R-)、c(OH-)>c(H+) D. a~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
)>c(R-)、c(OH-)>c(H+) D. a~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
【答案】D
【解析】A.根据图知,0.1mol/L的HR溶液pH>1,说明HR部分电离,则HR为弱酸,A错误;B.酸或碱抑制水电离,且酸中c(H+)越大、碱中c(OH-)越大,其抑制水电离程度越大,含有弱离子的盐促进水电离,a溶液呈酸性抑制水电离,b点溶液恰好反应,生成的盐水解,促进水的电离,B错误;C.b点溶液的pH=7,则溶液中存在c(H+)=c(OH-),结合电荷守恒得c(NH4+)=c(R-),该点溶液中水电离程度很小,所以离子浓度大小顺序是c(NH4+)=c(R-)>c(OH-)=c(H+),C错误;D.离子积常数只与温度有关,温度不变,离子积常数不变,所以这几点溶液中离子积常数不变,D正确;答案选D。

【题目】下列除杂质选用试剂和主要操作都正确的是
选项 | 物质 | 杂质 | 试剂 | 主要操作 |
A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
B | CO2 | CO | O2 | 点燃 |
C | FeCl2溶液 | FeCl3 | Cu | 过滤 |
D | CH3CH2OH | H2O | Na | 蒸馏 |
A. A B. B C. C D. D
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)①和④的元素符号是________和________;
(2)表中最活泼的金属是________,非金属性最强的元素是________(填元素符号,下同);
(3)⑥的原子结构示意图为_____________;
(4)表中能形成两性氢氧化物的元素是________,写出该元素的氢氧化物与③最高价氧化物的水化物反应的化学方程式:___________________________________;
(5)⑦、⑧的氢化物热稳定性较强的是________(填氢化物化学式)。