题目内容
10.下列说法正确的是( )| A. | 强电解质溶液的导电能力一定比弱电解质溶液的强 | |
| B. | 盐酸和醋酸,只要物质的量浓度相同,电离程度也相同 | |
| C. | 强电解质的稀溶液中不存在溶质分子 | |
| D. | 强电解质都是离子化合物,弱电解质都是共价化合物 |
分析 A.溶液导电能力由溶液中离子浓度大小决定,与电解质强弱无关;
B.盐酸为强酸,醋酸为弱酸,电离程度不同;
C.强电解质溶液中只有离子,没有电解质分子,但有水分子;
D.强酸均是共价化合物,均属于强电解质.
解答 解:A.溶液导电能力由溶液中离子浓度大小决定,与电解质强弱无关;故A错误;
B.盐酸为强酸,醋酸为弱酸,同等浓度的盐酸电离程度大于醋酸,故电离程度不同,故B错误;
C.强电解质溶液中只有离子,没有电解质分子,但有水分子,故C正确;
D.强酸均是共价化合物,均属于强电解质,比如HCl、H2SO4、HNO3等,故D错误,故选:C.
点评 本题考查了电解质强弱与溶液导电性,明确电解质溶液导电的原因和导电强弱影响因素、明确电解质的强弱本质区别是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列各组中,不管以何种比例混合,只要总质量一定,充分燃烧后生成的二氧化碳的量不变的是( )
| A. | 乙炔(C2H2)和甲苯 | B. | 乙醇和丙醇(CH3CH2CH2OH) | ||
| C. | 乙醇和乙醚(C2H5OC2H5) | D. | 甲醛( HCHO)和乙酸 |
1.基态原子的核外电子排布的原则不包括( )
| A. | 能量最低原则 | B. | 能量守恒原理 | C. | 泡利不相容原理 | D. | 洪特规则 |
18.已知反应N2(g)+3H2(g)?3NH3(g)△H<0,能增大正反应速率的措施是( )
| A. | 通入N2 | B. | 扩大容器容积 | C. | 移去部分NH3 | D. | 降低体系温度 |
5.下列每组中各有两对物质,它们都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水、酒精和水 | B. | 四氯化碳和水、苯和液溴 | ||
| C. | 硝基苯和水、乙酸和水 | D. | 苯和水、己烷和水 |
2.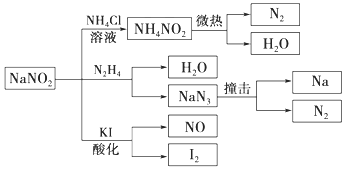 亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )
亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )
 亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )
亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )| A. | NaNO2在水中的溶解性大于NH4NO2 | |
| B. | NaNO2与N2H4反应中,NaNO2是氧化剂 | |
| C. | 可用KI、淀粉和食醋鉴别NaNO2和NaCl | |
| D. | 分解NaN3盐每产生1 mol N2 转移6 mol e- |
19.工业上制备纯硅反应是SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+QkJ•mol-1(Q>0).某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
| A. | 反应过程中,若降低压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则平衡时,吸收热量为QkJ | |
| C. | 将反应的温度由T1升高至T2,则反应的平衡常数K1>K2 | |
| D. | 当反应吸收热量为0.25QkJ时,生成的HCl恰好能与1 molNaOH反应 |
4.CoCl2•6H2O是制备钴酸锂电池用四氧化三钴粉末的主要原料,工业上利用水钴矿(主要成分为Co2O3、Fe2O3、FeO、Al2O3等)制取CoCl2•6H2O的简化工艺流程如图所示:
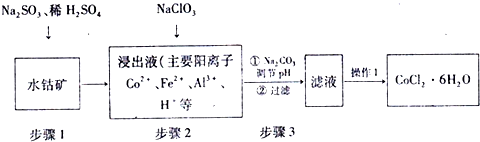
(1)步骤1中三价钴转变为二价钴的离子反应方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)步骤2中加入的NaClO3目的是将Fe2+氧化成Fe3+,方便利用水解除去铁离子,同时为溶液提供氯离子.
(3)部分金属阳离子以氢氧化物形式沉淀时的pH情况如下:
步骤3中加入Na2CO3目的是除去铁和铝元素,其之所以可以除去铁和铝元素的原因是CO32-与H+反应消耗H+,促使Fe3+、Al3+水解平衡右移,生成Fe(OH)3、Al(OH)3沉淀而将其除去.理论上,此步pH应该控制的范围是5.4≤PH<7.6.
(4)操作1包括以下基本实验操作,它们是蒸发浓缩、冷却结晶和过滤、洗涤、风干.
(5)已知:Ag++SCN-=AgSCN↓,为测定粗品中CoCl2•6H2O的含量,称取11.9克粗品溶于水配成100mL溶液,从中取出25.00mL,先加入含AgNO30.03mol的溶液(杂质不反应),过量的AgNO3用0.50mol•L-1的KSCN溶液滴定,该滴定所用指示剂为Fe(NO3)3;若消耗KSCN溶液20.00mL则该粗品中CoCl2•6H2O的质量含量为80%.

(1)步骤1中三价钴转变为二价钴的离子反应方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)步骤2中加入的NaClO3目的是将Fe2+氧化成Fe3+,方便利用水解除去铁离子,同时为溶液提供氯离子.
(3)部分金属阳离子以氢氧化物形式沉淀时的pH情况如下:
| 金属阳离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
| 开始沉淀的pH | 2.2 | 4.1 | 7.5 | 7.6 |
| 沉淀完全的pH | 3.5 | 5.4 | 9.5 | 9.2 |
(4)操作1包括以下基本实验操作,它们是蒸发浓缩、冷却结晶和过滤、洗涤、风干.
(5)已知:Ag++SCN-=AgSCN↓,为测定粗品中CoCl2•6H2O的含量,称取11.9克粗品溶于水配成100mL溶液,从中取出25.00mL,先加入含AgNO30.03mol的溶液(杂质不反应),过量的AgNO3用0.50mol•L-1的KSCN溶液滴定,该滴定所用指示剂为Fe(NO3)3;若消耗KSCN溶液20.00mL则该粗品中CoCl2•6H2O的质量含量为80%.