��Ŀ����
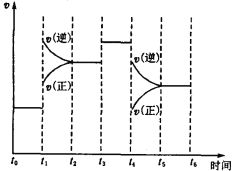
����Ŀ����һ������Cl2ͨ��һ��Ũ�ȵĿ��Լ���Һ�У�����ǡ����ȫ��Ӧ(��֪��Ӧ���̷���)���������������ֺ���Ԫ�ص����ӣ�����ClO����ClO3-�������ӵ����ʵ���(n)�뷴Ӧʱ��(t)�ı仯ʾ��ͼ��ͼ��ʾ������˵������ȷ����

A. Cl2�Ϳ��Լ���Һ�ڲ�ͬ�¶��¿��ܷ�����ͬ��Ӧ
B. ��Ӧ��ת�Ƶ�����Ϊ��0.21 NA
C. ԭ���Լ���Һ��KOH�����ʵ�����ȷ��
D. ��������Cl�� �����ʵ���Ϊ 0.21 mol
���𰸡�C
��������
A�0~t1�����ķ�ӦΪCl2+2OH-=Cl-+ClO-+H2O����Ӧ���ȣ��¶����ߣ�t1~t2�ַ�����Ӧ3Cl2+6OH-=ClO3-+5Cl-+3H2O��Cl2�Ϳ��Լ���Һ�ڲ�ͬ�¶��·�����ͬ�ķ�Ӧ����A��ȷ��
B�����ͼ���֪��Ӧ������KClO��KClO3�ֱ���0.06mol��0.03mol����Ӧ��ת�Ƶ�����Ϊ0.06mol��1+0.03mol��5=0.21mol��B����ȷ��
C����ݵ�ʧ�����غ��֪�������Ȼ������ʵ�����0.21mol������K+�غ㣬���Բμӷ�Ӧ�������������ʵ���Ϊ0.06mol+0.03mol+0.21mol=0.3mol��C�����
D����ݵ�ʧ�����غ��֪������Cl- ���ʵ�����0.21mol��D����ȷ��
��ѡC��

 ѧϰʵ����ϵ�д�
ѧϰʵ����ϵ�д�����Ŀ����ӦCO(g)+2H2(g)CH3OH(g).��Ӧ��ƽ�ⳣ�����������˵����ȷ����( )
�¶�/�� | 0 | 100 | 200 | 300 | 400 |
ƽ�ⳣ�� | 667 | 13 | 1.9��102 | 2.4��104 | 1��105 |
A. �÷�Ӧ����H>0
B. ��ѹ�����������COŨ�ȶ������CO��ת����
C. ��ҵ�ϲ��ø��¸�ѹ��������Ŀ�Ķ������ԭ������ת����
D. t��ʱ,��1L�ܱ�������Ͷ��0.1molCO��0.2molH2��ƽ��ʱCOת����Ϊ50%����÷�Ӧ�¶���0-100��֮��