题目内容
将12mL1.00mol/LNaCl溶液和40mL0.50mol/LCaCl2溶液混合后,溶液中Cl-的物质的量浓度是( )
| A、0.5mol/L | B、0.67mol/L | C、2.00mol/L | D、1.00mol/L |
分析:分别利用n=cV来计算溶液中溶质的物质的量,从而确定Cl-的物质的量,最后利用c=
来计算混合液中Cl-的物质的量浓度.
| n |
| V |
解答:解:NaCl的物质的量为0.012L×1mol/L=0.0012mol,
CaCl2的物质的量为0.04L×0.5mol/L=0.02mol,
则Cl-的物质的量为0.012mol+0.02mol×2=0.052mol,
混合溶液的体积为0.012L+0.04L=0.052L,
则混合液中Cl-的物质的量浓度为
=1mol/L,
故选D.
CaCl2的物质的量为0.04L×0.5mol/L=0.02mol,
则Cl-的物质的量为0.012mol+0.02mol×2=0.052mol,
混合溶液的体积为0.012L+0.04L=0.052L,
则混合液中Cl-的物质的量浓度为
| 0.052mol |
| 0.052L |
故选D.
点评:本题考查混合溶液中离子浓度的计算,明确物质的量、体积、浓度的关系即可解答,并注意溶液体积的变化忽略不计来分析解答.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
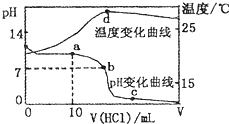 室温下,将1.00mol?L-1盐酸滴入20.00 mL 1.00mol?L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
室温下,将1.00mol?L-1盐酸滴入20.00 mL 1.00mol?L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )A、a点溶液中离子浓度大小的关系:c(NH
| ||
B、b点溶液中离子浓度大小的关系:c(NH
| ||
C、c点溶液中离子浓度大小的关系:c(NH
| ||
| D、d点时溶液温度达到最高,之后温度略有下降,原因是NH3?H2O电离吸热 |
 (2012?河西区一模)室温下,将1.00mol?Lˉ1盐酸滴入20.00mL 1.00mol?Lˉ1氨水中,溶液pH随加入盐酸体积变化的曲线如右图所示.下列说法正确的是( )
(2012?河西区一模)室温下,将1.00mol?Lˉ1盐酸滴入20.00mL 1.00mol?Lˉ1氨水中,溶液pH随加入盐酸体积变化的曲线如右图所示.下列说法正确的是( ) 室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(℃)
室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(℃)