题目内容
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+ ![]() O2(g) =CO2(g)+2H2O(g)ΔH=-a kJ/mol,则a___238.6(填“>”、“<”或“=”)。
O2(g) =CO2(g)+2H2O(g)ΔH=-a kJ/mol,则a___238.6(填“>”、“<”或“=”)。
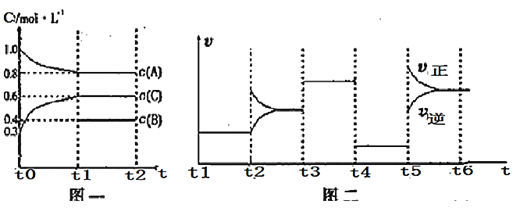
(2)如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过分析,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为_______、________。
(3)反应mA(g)+nB(g)![]() pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
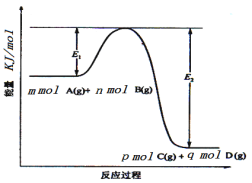
该反应ΔH=____kJ/mol(用含E1、E2式子表示);在反应体系中加入催化剂,E1___,E2___,(填增大、减小、不变)。
(4)已知:CO (g) +H2O (g)![]() H2 (g) +CO2 (g) K,C(s)+CO2(g)
H2 (g) +CO2 (g) K,C(s)+CO2(g)![]() 2CO(g) K1,C(s) +H2O(g)
2CO(g) K1,C(s) +H2O(g)![]() CO(g) +H2(g) K2 ,则K、K1、K2之间的关系是 ___________。
CO(g) +H2(g) K2 ,则K、K1、K2之间的关系是 ___________。
【答案】< H2O(l)= H2(g)+![]() O2(g) ΔH=+286 kJ/mol H2S (g)= H2(g)+S(s) ΔH=+20 kJ/mol ΔH=-(E2-E1)kJ/mol 减小 减小 K=
O2(g) ΔH=+286 kJ/mol H2S (g)= H2(g)+S(s) ΔH=+20 kJ/mol ΔH=-(E2-E1)kJ/mol 减小 减小 K=![]()
【解析】
根据燃烧热的概念分析比较反应热的大小;根据盖斯定律计算反应热并书写热化学方程式;根据催化剂对反应速率的影响原理分析解答;根据平衡常数表达式进行相关计算。
(1)燃烧热是指可燃物完全燃烧生成稳定的氧化物所放出的热量,反应CH3OH(l)+ ![]() O2(g) =CO2(g)+2H2O(g) ΔH=-a kJ/mol,因H2O(l)转化为H2O(g)需要吸收热量,故a<238.6,故答案为:<;
O2(g) =CO2(g)+2H2O(g) ΔH=-a kJ/mol,因H2O(l)转化为H2O(g)需要吸收热量,故a<238.6,故答案为:<;
(2)根据系统I中反应,运用盖斯定律将3个反应相加得:H2O(l)= H2(g)+![]() O2(g) ΔH=ΔH1+ΔH3+ΔH3=+327 kJ/mol-151 kJ/mol+110 kJ/mol=+286 kJ/mol,即热化学方程式为:H2O(l)= H2(g)+
O2(g) ΔH=ΔH1+ΔH3+ΔH3=+327 kJ/mol-151 kJ/mol+110 kJ/mol=+286 kJ/mol,即热化学方程式为:H2O(l)= H2(g)+![]() O2(g) ΔH=+286 kJ/mol ;将系统II中3个反应相加得:H2S (g)= H2(g)+S(s) ΔH=ΔH2+ΔH3+ΔH4=-151 kJ/mol+110 kJ/mol+61 kJ/mol=+20 kJ/mol,即热化学方程式为:H2S (g)= H2(g)+S(s) ΔH=+20 kJ/mol,故答案为:H2O(l)= H2(g)+
O2(g) ΔH=+286 kJ/mol ;将系统II中3个反应相加得:H2S (g)= H2(g)+S(s) ΔH=ΔH2+ΔH3+ΔH4=-151 kJ/mol+110 kJ/mol+61 kJ/mol=+20 kJ/mol,即热化学方程式为:H2S (g)= H2(g)+S(s) ΔH=+20 kJ/mol,故答案为:H2O(l)= H2(g)+![]() O2(g) ΔH=+286 kJ/mol ;H2S (g)= H2(g)+S(s) ΔH=+20 kJ/mol ;
O2(g) ΔH=+286 kJ/mol ;H2S (g)= H2(g)+S(s) ΔH=+20 kJ/mol ;
(3)由图象可知E1表示反应物断键吸收的总能量,E2表示生成物形成放出的总能量,△H=反应物断键吸收的总能量生成物形成放出的总能量=E1E2,反应为放热反应,则△H=(E2E1)kJ/mol,加入催化剂能降低反应的活化能,所以E1和E2均减小,故答案为:-(E2E1)kJ/mol;减小;减小;
(4)根据平衡常数表达式分析知:CO (g) +H2O (g)![]() H2 (g) +CO2 (g)是 由C(s) +H2O(g)
H2 (g) +CO2 (g)是 由C(s) +H2O(g)![]() CO(g) +H2(g)减去C(s)+CO2(g)
CO(g) +H2(g)减去C(s)+CO2(g)![]() 2CO(g) 所得,则K、K1、K2之间的关系是K=
2CO(g) 所得,则K、K1、K2之间的关系是K=![]() ,故答案为:K=
,故答案为:K=![]() 。
。