题目内容
【题目】已知以下的热化学反应方程式:
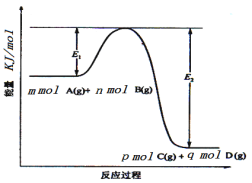
Fe2O3(s)+![]() CO(g)=2/3Fe3O4(s)+
CO(g)=2/3Fe3O4(s)+![]() CO2(g) ΔH=-15.73kJ/mol
CO2(g) ΔH=-15.73kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4kJ/mol
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
则56gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A.-327kJ/molB.+327kJ/mol
C.+436kJ/molD.-436kJ/mol
【答案】D
【解析】
给以上热化学方程式依次编号
①Fe2O3(s)+![]() CO(g)=2/3Fe3O4(s)+
CO(g)=2/3Fe3O4(s)+![]() CO2(g) ΔH=-15.73kJ/mol
CO2(g) ΔH=-15.73kJ/mol
②Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4kJ/mol
③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
由盖斯定律可知,反应FeO(s)+CO(g)=Fe(s)+CO2(g)可由![]() 得到,其反应热为
得到,其反应热为![]() ,则56gCO即1molCO还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH为-436kJ/mol,D项正确;
,则56gCO即1molCO还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH为-436kJ/mol,D项正确;
答案选D。

【题目】已知反应2CH3OH(g) ![]() CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是( )
A.该反应的平衡常数表达式为K=![]()
B.平衡时c(CH3OH)=0.04 mol·L-1
C.该时刻正、逆反应速率的大小:v正<v逆
D.若加入CH3OH后,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=1.6 mol·L-1·min-1
【题目】下列实验操作、现象和结论均正确,且存在对应关系的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 将 | 先无现象后产生白色胶状沉淀 |
|
B | 向2支盛有醋酸和硼酸溶液的管中分别滴加 | 醋酸:产生气泡; 硼酸:无现象 |
|
C | 将少量 | 沉淀由红褐色变为白色 |
|
D | 溴乙烷、乙醇及固体NaOH混合加热,产生的气态物质通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 溴乙烷发生消去反应生成了乙烯 |
A.AB.BC.CD.D