题目内容
【题目】世界能源消费依靠化学技术,作为燃料的H2通常来自水煤气。回答下列问题:
(1)己知:① C(s)+H2O(g)=CO(g)+H2(g)△H=akJ/mol②2C(s)+O2(g)=2CO(g) △H= -220 kJ/mol③2H2O(g)=2H2(g)+O2(g) △H=+480 kJ/mol,则 a=_____kJ/mol。
(2)某实验小组在实验室模拟反应C(s) +H2O (g)![]() CO (g) +H2 (g)能够说明该反应达到平衡状态的是____。
CO (g) +H2 (g)能够说明该反应达到平衡状态的是____。
a. v逆(H2O)=v正(CO) b.容器中物质的总质量不发生变化
c. n (H2O):n (H2)=1:1且不再改变 d.恒容容器中混合气体密度不变
(3)一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O发生反应①,6min时生成0.7 gH2则6 min内以CO表示的平均反应速率为 ______mol/Lmin-1 (保留2位有效数字)。
(4)燃料气中CO需氧化为CO2与氢气进行分离,使用CuO/CeO2做催化剂,并向其中加入不同的酸(HIO3 或H3PO4)后,CO的转化率随温度的变化如图所示。
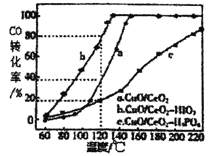
①加入H3PO4__________(填“促进”或,抑制”)CuO/CeO2的催化。
②CeO2可由草酸鋪[Ce2(C2O4)3]在空气中灼烧制备,同时只产生一种气体,写出该反应的化学方程式_____。
③恒温恒压下,在温度为120°C,催化剂为CuO/CeO2HIO3条件下反应,若起始时燃料气流速为1800mLmin-1,其中CO的体积分数为0.68%,则反应0.5h后剩余气体中CO的体积为__mL。
(5)有人将合成氨反应设计成原电池,装置如图所示。
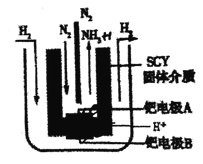
①正极反应式为 _______。
②己知该原电池的标准电动势![]() ,25°C时反应的平衡常数K与
,25°C时反应的平衡常数K与![]() 之间的关系为
之间的关系为![]() (n为原电池反应转移的电子数),则合成氨反应(N2 +3H2
(n为原电池反应转移的电子数),则合成氨反应(N2 +3H2![]() 2NH3)的平衡常数K为 ______(用含a的代数式表示,不需要化简)。
2NH3)的平衡常数K为 ______(用含a的代数式表示,不需要化简)。
【答案】+130 acd 0.029 抑制 Ce2(C2O4)3+2O2 ![]() 2CeO2+6CO2 73.44 N2+6e-+6H+═2NH3
2CeO2+6CO2 73.44 N2+6e-+6H+═2NH3 ![]()
【解析】
(1)已知:②2C(s)+O2(g)═2CO(g) △H=-220kJmol-1,③2H2O(g)=2H2(g)+O2(g) △H=+480 kJ/mol,可利用盖斯定律,将![]() 得到①C(s)+H2O(g)═CO(g)+H2(g)的反应热,以此解答该题;
得到①C(s)+H2O(g)═CO(g)+H2(g)的反应热,以此解答该题;
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3) 反应速率v=![]() ;
;
(4)①根据CO的转化率随温度的变化图分析;
②灼烧草酸铈[Ce2(C2O4)3],分解制得CeO2、一氧化碳以及二氧化碳,配平方程式即可;③温度为120℃,催化剂为CuO/CeO2-HIO3时,CO的转化率是80%,结合通入CO总体积计算;
(5)①原电池的正极发生还原反应,N2得电子还原生成NH3。
②己知N2 +3H2![]() 2NH3反应中转移电子数为6e-,原电池的标准电动势
2NH3反应中转移电子数为6e-,原电池的标准电动势![]() ,再结合
,再结合![]() 计算此反应的平衡常数K。
计算此反应的平衡常数K。
(1)已知:②2C(s)+O2(g)═2CO(g) △H=-220kJmol-1,③2H2O(g)=2H2(g)+O2(g) △H=+480 kJ/mol,可利用盖斯定律,将![]() 得到①C(s)+H2O(g)═CO(g)+H2(g),则△H=akJ/mol=
得到①C(s)+H2O(g)═CO(g)+H2(g),则△H=akJ/mol=![]() ×[(-220kJmol-1)+(+480 kJ/mol)]=+130 kJ/mol,即a=+130;
×[(-220kJmol-1)+(+480 kJ/mol)]=+130 kJ/mol,即a=+130;
(2)a.v逆(H2O)=v正(CO),达到平衡状态,故a正确;
b.容器中物质的总质量一直不发生变化,不能说明达平衡状态,故b错误;
c.n (H2O):n (H2)=1:1且不再改变,说明n(H2O)和n(H2)的物质的量一定,此时反应达到平衡状态,故c正确;
d.混合气体的体积不变,但混合气体的总质量不确定,当密度不变,则说明混合气体的总质量不再发生变化,说明达平衡状态,故d正确;
故答案为acd;
(3) 一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2,其物质的量为![]() =0.35mol,由C(s) +H2O (g)
=0.35mol,由C(s) +H2O (g)![]() CO (g) +H2 (g)反应可知生成CO的物质的量为0.35mol,则6min内以CO表示的平均反应速率=
CO (g) +H2 (g)反应可知生成CO的物质的量为0.35mol,则6min内以CO表示的平均反应速率= 0.029mol/(Lmin);
0.029mol/(Lmin);
(4)①图示可知,相同温度下,在CuO/CeO2催化剂中加入H3PO4时CO的转化率最低,说明加人H3PO4抑制CuO/CeO2的催化;
②灼烧草酸铈[Ce2(C2O4)3],分解制得CeO2![]() 2CeO2+4CO↑+2CO2↑;
2CeO2+4CO↑+2CO2↑;
③温度为120℃,催化剂为CuO/CeO2-HIO3时,CO的转化率是80%,若燃料气流速为1800mLmin-1,CO的体积分数为0.68%,则反应0.5小时后CO的体积为1800mLmin-1×0.5h×60min/h×0.68%×(1-80%)=73.44ml;
(5)①原电池的正极发生还原反应,N2得电子还原生成NH3,则正极反应式为N2+6e-+6H+═2NH3;
②己知N2 +3H2![]() 2NH3反应中转移电子数为6e-,原电池的标准电动势
2NH3反应中转移电子数为6e-,原电池的标准电动势![]() ,再结合
,再结合![]() ,则平衡常数K=
,则平衡常数K=![]() 。
。

 智慧小复习系列答案
智慧小复习系列答案