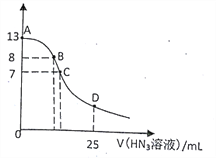
题目内容
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂的标签部分内容。据此判断,下列说法正确的是( )

A. 1 mol Al 与足量的该硫酸产生2 g氢气
B. 配制 240 mL 4.6 mol/L 的稀硫酸需取该硫酸 40 mL
C. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干
D. 该硫酸与等质量的水混合后所得溶液的物质的量浓度小于9.2 mol/L
【答案】D
【解析】质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度=![]() =18.4mol/L,为浓硫酸;A.Al常温下遇浓硫酸钝化,加热条件下也只能得到还原性气体SO2,不可能生成氢气,故A错误;B.因配制 240 mL时需要选择250mL的容量瓶,则配制250ml4.6mol/L的稀硫酸需取该硫酸为
=18.4mol/L,为浓硫酸;A.Al常温下遇浓硫酸钝化,加热条件下也只能得到还原性气体SO2,不可能生成氢气,故A错误;B.因配制 240 mL时需要选择250mL的容量瓶,则配制250ml4.6mol/L的稀硫酸需取该硫酸为![]() =62.5mL,故B错误;C.配制物质的量浓度时容量瓶不需要干燥,故C错误;D.浓硫酸浓度越大其密度越大,硫酸密度大于水密度,等质量硫酸和水,水的体积大于硫酸体积,所以二者混合后溶液体积大于浓硫酸的二倍,则其物质的量浓度小于原来的
=62.5mL,故B错误;C.配制物质的量浓度时容量瓶不需要干燥,故C错误;D.浓硫酸浓度越大其密度越大,硫酸密度大于水密度,等质量硫酸和水,水的体积大于硫酸体积,所以二者混合后溶液体积大于浓硫酸的二倍,则其物质的量浓度小于原来的![]() ,即小于9.2mol/L,故D正确;答案为D。
,即小于9.2mol/L,故D正确;答案为D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】下列实验操作能达到实验目的是( )
实验目的 | 实验操作 | |
A | 配制1.0mol/L CuSO4溶液 | 把25g胆矾晶体溶于水配成100mL溶液 |
B | 证明某溶液中含有SO42﹣ | 向该溶液中滴入BaCl2溶液 |
C | 实验室制大量CO2 | 向稀硫酸中加入大理石 |
D | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到热NaOH溶液中 |
A.A
B.B
C.C
D.D