题目内容
6.(1)1.204×1024个Na+约含2mol Na+,其质量为46g(2)4.9gH2SO4是0.05mol,其中6.02×1022个H,共含3.5mol原子
(3)标准状况下,11.2LCO2的物质的量为0.5mol,与14gN2含有相同的物质的量
(4)等物质的量的CO和CO2其质量之比为7:11,分子数之比为1:1.
(5)配制0.92mol/L的稀硫酸100mL需要18.4mol/L的浓硫酸5mL.
(6)现有质量分数为98%、密度为1.84g/cm3的浓硫酸求c=18.4mol/L.
分析 (1)根据n=$\frac{N}{{N}_{A}}$计算,m=nM计算;
(2)根据N=nNA=$\frac{m}{M}$NA求出硫酸分子的个数,再根据一个硫酸分子中含有的氢原子数、原子总数求出氢原子的个数、原子总数;
(3)n(CO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据m=nM;
(4)等物质的量的CO和CO2其质量之比等于摩尔质量之比,分子数之比等物质的量之比;
(5)根据溶液稀释过程中溶质的物质的量不变计算出需要浓硫酸的体积;
(6)根据c=$\frac{1000ρw}{M}$计算该浓硫酸的物质的量浓度.
解答 解:(1)根据n=$\frac{N}{{N}_{A}}$=$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}}$=2mol,m=nM=2mol×23g/mol=46g,故答案为:2;46;
(2)一个硫酸分子中含有2个氢原子、7个原子,所以氢原子和原子的物质的量分别为:N(H)=
2nNA=2×$\frac{4.9g}{98g/mol}$×6.02×1023=6.02×1022个
n(原子)=7n=7×$\frac{4.9g}{98g/mol}$=3.5 mol;
故答案为0.05,6.02×1022,3.5;
(3)n(CO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据m=nM=0.5mol×28g/mol=14g,故答案为:0.5;14;
(4)等物质的量的CO和CO2其质量之比等于摩尔质量之比,所以质量之比为28:44=7:11,分子数之比等物质的量之比等于1:1,故答案为:7:11;1:1;
(5)0.92mol/L的稀硫酸100mL的稀硫酸,需要18.4mol/L的浓硫酸的体积为:$\frac{0.92mol/L×0.1L}{18.4ml/L}$=0.005L=5mL,故答案为:5;
(6)密度为1.84g/cm3、质量分数为 98% 的浓硫酸,其物质的量浓度=$\frac{1000×1.84×98%}{98}$mol/L=18.4 mol/L,故答案为:18.4.
点评 本题考查物质的量和物质的量浓度计算,注意理解质量分数与物质的量浓度关系,难度不大,也可以利用定义式计算.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案| A. | 30mL0.2mol/LKCl溶液 | B. | 20mL0.1mol/LCaCl2溶液 | ||
| C. | 10mL0.1mol/LAlCl3溶液 | D. | 100mL0.25mol/LNaCl溶液 |
化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2,
在温度973K和1173K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(2)现有反应③:CO2(g)+H2(g)??ΧΟ(γ)+Η2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=$\frac{[CO][H{\;}_{2}O]}{[H{\;}_{2}][CO{\;}_{2}]}$.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式$\frac{K{\;}_{1}}{K{\;}_{2}}$,据此关系式及上表数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应.
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,
可采取的措施有CE(填写字母序号).
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO的浓度.
| A. | 44 g | B. | 22 g | C. | 18 g | D. | 9 g |
| A. | 10 g NaOH固体溶解在水中配成250mL溶液 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 将1L 10 mol•L-1的浓盐酸与9L水混合 | |
| D. | 将40g NaOH固体溶解于1L水中 |
①核内质子数②核外电子数③最外层电子数④原子序数.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②③④ |
 F的原子结构示意图为
F的原子结构示意图为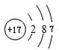 .
.