题目内容
(15分)(1)A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出。

①若反应①②③均为水溶液中的置换反应,A、D、E都为卤素单质,化合物中的阳离了均为Na+,则A、D、E的氧化性由弱到强的顺序为 (写化学式)。在一定条件下E和D以物质的量比为5:l在硫酸溶液中恰好完全反应,写出该反应的离子方程式: 。
②若把B、C、F三种溶液汇集在一起得到1L混合溶液,并物质的转化关系给其中加入一定量的E,溶液中卤素阴离子的物质的量与通入E的体积(标准状况)的关系如下表所示(x和y均大于0)。
各离子的量与E的体积的关系

I.当通入E的体积为2.8L时,溶液中发生反应的离子方程式为 。
II.x= ,y= (填具体数据)。
III.当通入E的体积为11.2L时,该溶液中c(Na+)=____ mol·L-1(通入E后溶液的体积变化忽略不计)。
(2)用H2O2可除去工业尾气中的Cl2,相关反应:
H2O2(1)+Cl2(g) 2HCl(g)+O2(g)△H>0.
2HCl(g)+O2(g)△H>0.
①为了提高H2O2的除氯效果,采取的措施最好的是 (只改变一种条件),其原因是: 。
(g)+ O2(g)= H2O(1), △H2 = -285.84kJ·mol-l
O2(g)= H2O(1), △H2 = -285.84kJ·mol-l
Cl2(g)+ H2(g)= 2HCl(g), △H3 = -184.6kJ·mol-l
则H2O2(1)与Cl2(g)反应生成HCl(g)和O2(g)的热化学方程式为 。

①若反应①②③均为水溶液中的置换反应,A、D、E都为卤素单质,化合物中的阳离了均为Na+,则A、D、E的氧化性由弱到强的顺序为 (写化学式)。在一定条件下E和D以物质的量比为5:l在硫酸溶液中恰好完全反应,写出该反应的离子方程式: 。
②若把B、C、F三种溶液汇集在一起得到1L混合溶液,并物质的转化关系给其中加入一定量的E,溶液中卤素阴离子的物质的量与通入E的体积(标准状况)的关系如下表所示(x和y均大于0)。
各离子的量与E的体积的关系

I.当通入E的体积为2.8L时,溶液中发生反应的离子方程式为 。
II.x= ,y= (填具体数据)。
III.当通入E的体积为11.2L时,该溶液中c(Na+)=____ mol·L-1(通入E后溶液的体积变化忽略不计)。
(2)用H2O2可除去工业尾气中的Cl2,相关反应:
H2O2(1)+Cl2(g)
 2HCl(g)+O2(g)△H>0.
2HCl(g)+O2(g)△H>0.①为了提高H2O2的除氯效果,采取的措施最好的是 (只改变一种条件),其原因是: 。
(g)+
 O2(g)= H2O(1), △H2 = -285.84kJ·mol-l
O2(g)= H2O(1), △H2 = -285.84kJ·mol-lCl2(g)+ H2(g)= 2HCl(g), △H3 = -184.6kJ·mol-l
则H2O2(1)与Cl2(g)反应生成HCl(g)和O2(g)的热化学方程式为 。

试题分析:⑴①若反应①②③均为水溶液中的置换反应,A、D、E都为卤素单质,则A为Br2,D为I2,E为Cl2,三者的氧化性由弱到强的顺序为I2<Br2<Cl2;在一定条件下E(Cl2)和D(I2)以物质的量比为5:l在硫酸溶液中恰好完全反应,据得失电子守恒有5Cl2+I2――10Cl-+2IO3-,再据电荷守恒有5Cl2+I2――10Cl-+2IO3-+12H+,最后据原子守恒得5Cl2+I2+6H2O=10Cl-+2IO3-+12H+。
②由于B为NaI、C为NaBr、F为NaCl,E为Cl2,据表中的数据说明当E(Cl2)通入2.8L→5.6L时依次发生的离子反应为:
Cl2 + 2I- = 2Cl- + I2 Cl2 + 2Br-
 2Cl- + Br2
2Cl- + Br20.15mol 1.5-1.25-0.1=0.15mol 0.1mol 0.1mol
则x=0.15mol,y=1.4-(2-1.5)=0.9mol;
当通入E的体积为11.2L时,据电荷守恒得该溶液中c(Na+)=2+0.9=2.9mol·L-1。
⑵①根据反应原理(吸热反应),升高温度,反应速率增大,平衡向右移,提高H2O2的除氯效果(减压虽能使平衡向右移动,但会导致反应速率慢,故不是最好措施);
②据题意先写出反应方程式并标出各物质的状态H2O2(l)+ Cl2(g)=2HCl(g)+ O2(g),依次將三条热化学方程式编号为①②③,将“①×
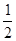 -②+③”得该反应方程式,据盖斯定律得该反应的反应热△H=(-196.46)×
-②+③”得该反应方程式,据盖斯定律得该反应的反应热△H=(-196.46)×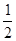 -(-285.84)+(-184.6)=+3.01kJ·mol-l,据此便可写出完整的热化学方程式。
-(-285.84)+(-184.6)=+3.01kJ·mol-l,据此便可写出完整的热化学方程式。
练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
 2SO3(g)
2SO3(g) 2SO3(g) △H= 。
2SO3(g) △H= 。

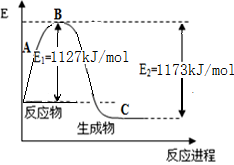
 (保留两位有效数字);第12 min时改变的反应条件可能为________。
(保留两位有效数字);第12 min时改变的反应条件可能为________。 的HCOONa溶液pH =10,则HCOOH的电离常数
的HCOONa溶液pH =10,则HCOOH的电离常数 =_________。
=_________。
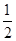 O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1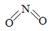 和
和 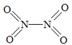 。
。