题目内容
(15分)为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1
则2NO(g+2CO(g)=N2(g)+2CO2(g)) △H= kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。

①CO在0-9min内的平均反应速率v(CO)=________mol (保留两位有效数字);第12 min时改变的反应条件可能为________。
(保留两位有效数字);第12 min时改变的反应条件可能为________。
②该反应在第24 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K=________(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表示)。
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1 mol 的HCOONa溶液pH =10,则HCOOH的电离常数
的HCOONa溶液pH =10,则HCOOH的电离常数 =_________。
=_________。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1
则2NO(g+2CO(g)=N2(g)+2CO2(g)) △H= kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。

①CO在0-9min内的平均反应速率v(CO)=________mol
 (保留两位有效数字);第12 min时改变的反应条件可能为________。
(保留两位有效数字);第12 min时改变的反应条件可能为________。| A.升高温度 | B.加入NO | C.加催化剂 | D.降低温度 |
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表示)。
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1 mol
 的HCOONa溶液pH =10,则HCOOH的电离常数
的HCOONa溶液pH =10,则HCOOH的电离常数 =_________。
=_________。(1)-746.5(3分)
(2)①4.4×10-3(2分) D(1分) ②22.2%(2分)3.4(2分)
(3)2c(SO
 )+c(HSO
)+c(HSO )(2分)
)(2分)(4)1.0×10-7(3分)
试题分析:
(1)① N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
② 2C(s) +O2(g)=2CO2(g) △H=-787kJ·mol-1
③ 2CO(g) +O2(g)=2CO2(g) △H=-566kJ·mol-1
③-①得:
2NO(g+2CO(g)=N2(g)+2CO2(g)) △H=-746.5kJ·mol-1
(2) ①在前九秒钟浓度减少了0.04mol/L,所以v(CO)=4.4×10-3;该反应的正向是放热反应,A升高温度向吸热的方向移动,一氧化碳和一氧化氮的浓度应该升高,错误;B加入一氧化氮时,一氧化氮的浓度应该是先升高再降低,图中不符,错误;C加入催化剂,不会影响化学平衡,也就是说一氧化碳和一氧化氮的浓度不会发生变化。错误;D降低温度,平衡正向移动,符合图中的曲线变化,正确。
② 2NO(g + 2CO(g) = N2(g) + 2CO2(g)
起始:0.2mol 0.1mol 0 0
变化:2x mol 2x mol x mol 2x mol
平衡:(0.2-2 x) (0.1-2 x) x mol 2x mol
由题意得:(0.2-2 x)=0.14 所以x="0.03" mol
该反应在第24 min时达到平衡状态,CO2的体积分数为:
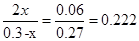
化学平衡常数为:
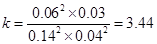
(3)Na2SO3和NaHSO3混合溶液中遵循电荷守恒:
c(Na+)+c(H+)=2c(SO42-)+c(HSO4-)+c(OH-),又因为是中性溶液,有:c(H+)=c(OH-)
所以:c(Na+) =2c(SO
 )+c(HSO
)+c(HSO )(2分)
)(2分)HCOO- +H2O
 HCOOH + OH-
HCOOH + OH- 起始:0.1mol/L 0 0
变化:0.0001mol/L 0.0001mol/L 0.0001mol/L
平衡:(0.1-0.0001)mol/L 0.0001mol/L 0.0001mol/L
所以该反应的水解平衡常数:Kh=1.0×10-7〔 (0.1-0.0001)mol/L近似等于0.1mol/L〕
又根椐

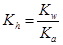 ,所以
,所以


练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 CH3OH(g)
CH3OH(g)



 2HCl(g)+O2(g)△H>0.
2HCl(g)+O2(g)△H>0. O2(g)= H2O(1), △H2 = -285.84kJ·mol-l
O2(g)= H2O(1), △H2 = -285.84kJ·mol-l


 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)