题目内容
只用一种试剂即可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是
| A.BaCl2 | B.H2SO4 | C.NaOH | D.AgNO3 |
B
解析试题分析:A、加入BaCl2,Na2SO4和(NH4)2SO4都生成白色沉淀,不能鉴别,故A错误;B、加入H2SO4,以上五种物质都不反应,不能鉴别,故B错误;C、加入NaOH,Na2SO4无现象,MgCl2生成白色沉淀,FeCl2生成白色沉淀,迅速变成灰绿色,最后总变成红褐色,Al2(SO4)3生成白色沉淀,NaOH过量时,沉淀逐渐溶解,(NH4)2SO4生成刺激性气体,五种物质现象各不相同,可鉴别,故C正确;D、加入AgNO3,以上物质都生成白色沉淀,不能鉴别,故D错误。
考点:物质的检验和鉴别的基本方法选择及应用

下列提纯物质的方法正确的是
| A.除去Mg粉中的Al粉:加入足量NaOH溶液后,过滤、洗涤 |
| B.除去BaCO3固体中混有的BaSO4:加入过量盐酸后,过滤、洗涤 |
| C.除去CO中混有的CO2:用足量NaOH洗气 |
| D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |
只用一种试剂即可区别下列四种溶液:Na2SO4、MgCl2、Al2(SO4)3、(NH4)2SO4,该试剂是
| A.稀H2SO4 | B.NaOH溶液 | C.BaCl2溶液 | D.Ba(OH)2溶液 |
为除去下列物质所含的杂质(括号内的物质),有关除杂试剂和操作合理的是
| A.乙醇(水):加氢氧化钙固体,过滤 |
| B.乙酸乙酯(乙酸):加氢氧化钠溶液,分液 |
| C.溴水(溴化钠):除杂过程中涉及的操作有:加CCl4,萃取、分液 |
| D.苯甲酸(苯甲酸钠):加稀硫酸,蒸馏 |
下列实验操作中错误的是
| A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.萃取操作时,在选择萃取剂时,要求萃取剂和原溶剂不互溶 |
已知滤渣2的主要成分是Fe(OH)3和Al(OH)3,由滤渣2制取Al2(SO4)3·18H2O,该探究小组设计了如下实验方案:
下列关于此方案的说法,错误的是
| A.加入NaOH溶液后过滤,滤渣为Fe(OH)3 |
| B.也可以先加硫酸,再加NaOH溶液后蒸发、冷却、结晶、过滤 |
| C.加硫酸后,溶液中的盐除含有硫酸铝外,还有硫酸钠 |
| D.如果滤渣2中含1molAl(OH)3,则至少需要1molNaOH才能使Al(OH)3完全溶解 |
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。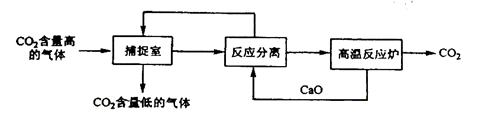
下列有关该方法的叙述中错误的是
| A.能耗大是该方法的一大缺点 |
| B.整个过程中,有两种物质可以循环利用 |
| C.捕捉到的CO2可用来制备甲醇等产品,可减少碳排放 |
| D.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤 |
某实验小组只领取下列仪器或用品:铁架台、铁圈、铁架、三角架、石棉网、烧杯、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、火柴、滤纸、漏斗。只应用上述仪器或用品,不能进行的实验操作是
| A.蒸发 | B.萃取 | C.过滤 | D.蒸馏 |
海水是重要的资源。可以制备一系列物质(见图)。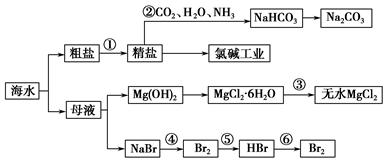
下列说法正确的是 ( )。
| A.步骤②中,应先通NH3,再通CO2 |
| B.步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水 |
| C.步骤④、⑤、⑥反应中,溴元素均被氧化 |
| D.除去粗盐中的SO32—、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸 |