题目内容
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
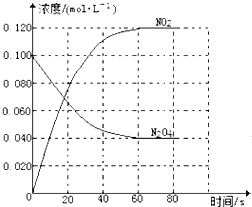
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________molL-1s-1,反应的平衡常数K1为_________
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____________________。
②列式计算温度T时反应的平衡常数K2 =________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动,判断理由是__________________。
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应2CH3OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
【答案】 大于 0.001 0.36 大于 c(N2O4)降低平衡正向移动,正反应为吸热反应,故温度升高 1.3 逆反应 增大压强平衡向气体体积减小的方向移动即逆反应方向 -45.5
【解析】本题分析:本题主要考查化学平衡。
(1)升温,平衡右移,反应的△H大于0;100℃时,在0~60s时段,N2O4减少0.060mol,反应速率v(N2O4)为0.001molL-1s-1,平衡浓度:c(N2O4)=0.040mol/L,c(NO2)=0.120mol/L,反应的平衡常数K1=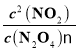 =0.36。
=0.36。
(2)①T大于100℃,判断理由是c(N2O4)降低平衡正向移动,正反应为吸热反应,故温度升高。
②平衡浓度:c(N2O4)=0.020mol/L,c(NO2)=0.160mol/L,平衡常数K2 = 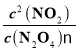 =1.3。
=1.3。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向逆反应方向移动,判断理由是增大压强平衡向气体物质的量减小的方向即逆反应方向移动。
(4)△H=△H1-2△H2-△H3=-45.5kJ·mol-1。

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是
千淘万漉虽辛苦,吹尽狂沙始到金 |
熬胆矾(CuSO4·5H2O) 铁釜,久之亦化为铜 |
凡石灰(CaCO3), 经火焚炼为用 |
丹砂(HgS)烧之成水银,积变又成丹砂 |
A | B | C | D |
A. A B. B C. C D. D