题目内容
【题目】下列叙述正确的是 ( )
A.在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行
B.除去NaCl中少量的![]() ,可将固体混合物制成热饱和溶液,冷却结晶、过滤
,可将固体混合物制成热饱和溶液,冷却结晶、过滤
C.将硫代硫酸钠溶液和稀硫酸混合,可通过观察产生气泡的快慢来判断化学反应速率
D.将铁钉放试管中,加入2mL水、3滴稀醋酸和1滴![]() 溶液,不久铁钉周围出现蓝色沉淀
溶液,不久铁钉周围出现蓝色沉淀
【答案】D
【解析】
A、测定中和热时应迅速加入碱液,防止热量散失;
B、硝酸钾的溶解度随温度变化较大,但含量少;
C、反应速率![]() ;
;
D、将铁钉放试管中,加入2mL水、3滴稀醋酸,铁会失电子变为![]() ;
;
A、测定中和热时应迅速加入碱液,防止热量散失,缓慢加入导致测得热量减少,故A错误;
B、硝酸钾的溶解度随温度变化较大,但含量少,故将固体混合物制成热饱和溶液,冷却结晶后,少量的硝酸钾难以析出,达不到除去硝酸钾的目的,故B错误;
C、反应速率![]() ,将硫代硫酸钠溶液和稀硫酸混合,可通过观察产生气泡的快慢来大体比较反应速率的快慢,但不能计算出反应速率大小,故C错误;
,将硫代硫酸钠溶液和稀硫酸混合,可通过观察产生气泡的快慢来大体比较反应速率的快慢,但不能计算出反应速率大小,故C错误;
D、将铁钉放试管中,加入2mL水、3滴稀醋酸,构成原电池,铁做负极,失电子变为![]() ,和滴入的
,和滴入的![]() 溶液反应生成蓝色沉淀,故D正确。
溶液反应生成蓝色沉淀,故D正确。
故选D。

【题目】CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I.甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
(1)下列措施中有利于增大该反应的反应速率的是___;
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
(2)已知:CO(g)+2H2(g)![]() CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) △H3
O2(g)=H2O(g) △H3
化学键 | H—H | O=O | O—H |
键能/KJmol-1 | 436 | 498 | 463.5 |
则△H3=___,表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___;
Ⅱ.当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)其平衡常数表达式为K=____。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是___。
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图。根据图中数据
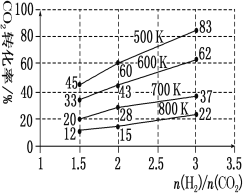
①降低温度,平衡向____方向移动。
②在700K、起始投料比![]() =1.5时,H2的转化率为___。
=1.5时,H2的转化率为___。
③在500K、起始投料比![]() =2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH
=2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH
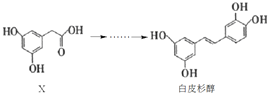
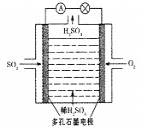
Ⅲ.某学习小组以SO2为原料,采用原电池法制取硫酸。该小组设计的原电池原理如图所示。该电池中右侧为___极,写出该电池负极的电极反应式___。
【题目】现有一瓶A和B的混合液,已知A和B的某些性质如下:
物质 | 分子式 | 熔点℃ | 沸点℃ | 密度 | 水溶性 |
A | C2H6O2 | -98 | 57.5 | 0.93 | 可溶 |
B | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
由此,分离A和B的最佳方法是( )
A.分馏B.升华C.萃取D.分液
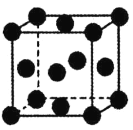
【题目】铜、锌及其化合物用途广泛。回答下列问题:
(1)Zn2+的价层电子轨道表达式为__。
(2)元素第二电离能(I2):Zn_Cu(填“>”“<”或“=”)。
(3)卤化锌的熔点如表所示:
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
溶点/℃ | 872 | 275 | 394 | 446 |
①ZnCl2、ZnBr2、ZnI2的熔点呈表中变化规律的原因___。
②ZnF2的熔点远高于其它三种卤化锌,其原因为___。
(4)邻氨基吡啶(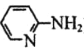 )的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
)的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
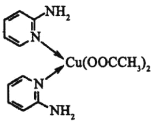
①邻氨基吡啶的铜配合物中,C原子杂化类型为__。
②1mol![]() 中σ键和π键的数目之比为__。
中σ键和π键的数目之比为__。
(5)铜的晶胞为面心立方(如图所示),已知晶胞参数为a,则该晶胞的空间利用率为__。(圆周率为π)。