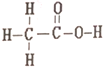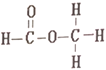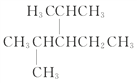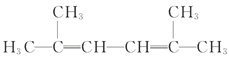题目内容
【题目】(NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是____。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_____ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(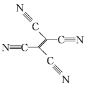 )。
)。
①CH3CN中碳原子的杂化方式是 ____ 和_____ 。
②TCNE中第一电离能较大的是 ___(填元素符号),分子中所有原子____(填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是 ___。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为 ___(列出计算式)g·cm-3。
【答案】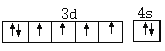 Fe的原子半径比Ca小,价电子数更多,金属键更强 N>S>H sp3 sp N 在 1:1
Fe的原子半径比Ca小,价电子数更多,金属键更强 N>S>H sp3 sp N 在 1:1 ![]()
【解析】
(1)Fe元素的原子序数为26,由电子排布规律书写价层电子的电子排布图;
(2)金属单质中金属原子的原子半径越大,价电子越少,金属键越弱,熔沸点越低;
(3)元素的非金属性越强,电负性越大;
(4)①—CH3中饱和碳原子的杂化方式是sp3杂化,—C≡N中饱和碳原子的杂化方式是sp杂化;
②TCNE分子是由4个氰基和1个碳碳双键构成,同一周期元素的第一电离能随着原子序数的增大而增大;氰基中碳原子和氮原子在同一直线上,碳碳双键上的碳原子和连接的原子在同一平面;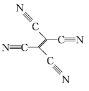 分子中含有9个σ 键和9个π键;
分子中含有9个σ 键和9个π键;
(5)由均摊法计算可得。
(1)Fe元素的原子序数为26,基态Fe原子价层电子的电子排布图(轨道表达式)为 ,故答案为:
,故答案为: ;
;
(2)Fe的价电子排布式为3d64s2,Ca的价电子排布式为4s2,Fe与Ca位于同一周期,Ca的原子半径较大,且价电子较少,金属键较弱,则金属Ca的熔点、沸点等都比金属Fe低,故答案为:Fe的原子半径比Ca小,价电子数更多,金属键更强;
(3)元素的非金属性越强,电负性越大,非金属性N>S>H,则电负性N>S>H,故答案为:N>S>H;
(4)①CH3CN分子中含有—CH3和—C≡N,—CH3中饱和碳原子的杂化方式是sp3杂化,—C≡N中饱和碳原子的杂化方式是sp杂化,故答案为:sp3;sp
②TCNE分子是由4个氰基和1个碳碳双键构成,C、N属于同一周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大而增大,则第一电离能大小顺序是N>C;氰基中碳原子和氮原子在同一直线上,碳碳双键上的碳原子和连接的原子在同一平面,则TCNE分子中所有原子在同一平面; 分子中含有9个σ 键和9个π键,σ 键与π键的数目之比为1:1,故答案为:N;在;1:1;
分子中含有9个σ 键和9个π键,σ 键与π键的数目之比为1:1,故答案为:N;在;1:1;
(5)由晶胞结构可知,每个碳原子周围有6个铁原子,构成正八面体,正八面体的化学式为Fe3C,体内碳原子形成1个正八面体、面心碳原子形成![]() 个正八面体、顶点和棱上碳原子形成
个正八面体、顶点和棱上碳原子形成![]() 个正八面体,则1个晶胞结构中含有4个Fe3C,由质量公式可得
个正八面体,则1个晶胞结构中含有4个Fe3C,由质量公式可得![]() =(4.515×10—8×5.077×10—8)×6.726×10—8d,解得密度d=
=(4.515×10—8×5.077×10—8)×6.726×10—8d,解得密度d=![]() g·cm-3,故答案为:
g·cm-3,故答案为:![]() 。
。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案