题目内容
【题目】(化学-物质结构与性质)氮及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态15N原子的p能级上存在_____个自旋方向相同的电子;CN—中σ键与π键数目之比为_____。
(2)碱性肥料氰氨化钙(CaCN2)的组成元素中第一电离能最小的是_______(填名称)。
(3)化合物(CH3)3N能溶于水,其原因是____________________________________,(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键类型为_______________。
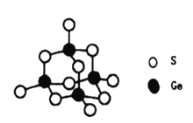
(4)阳离子[(CH3)3NH]+和阴离子A按个数比4:1组成化合物,阴离子A的结构如下图所示,则s原子的杂化轨道类型是__________,阴离子A的化学式为_______________。
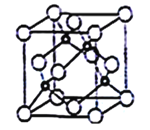
(5)立方氮化硼晶胞如下图所示(白球为氮原子,黑球为硼原子),则硼原子的配位数为___;若晶胞边长为acm,则立方氮化硼的密度是______g·cm-3(只要求列算式,阿伏加德罗常数用NA表示)。
【答案】3 1:2 钙 (CH3)3N为极性分子且能与水分子形成氢键 配位键 sp3 [Ge4S10]4- 4 100/(a3NA)
【解析】
(1)S电子云的形状为球形;N原子的电子排布式为1s22s22p3,轨道表示式为:![]() ,则p能级轨道上存在3个自旋方向相同的电子;CN-与N2为原子个数和价电子数相同的等电子体,等电子体具有相同的结构,氮气中存在氮氮三键,则CN-离子中存在碳氮三键,则离子中σ键与π键数目之比为1:2;
,则p能级轨道上存在3个自旋方向相同的电子;CN-与N2为原子个数和价电子数相同的等电子体,等电子体具有相同的结构,氮气中存在氮氮三键,则CN-离子中存在碳氮三键,则离子中σ键与π键数目之比为1:2;
(2)由于非金属性N>C>Ca,故第一电离能Ca<C<N,则第一电离能最小的是钙;
(3)(CH3)3N为结构不对称的极性分子,分子中氮原子非金属性强,原子半径小,和水之间形成氢键,所以(CH3)3N在水中溶解性增强;化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为(CH3)3N中氮原子与氢离子形成配位键;
(4)S原子的最外层电子数为6,由图可知S原子形成2个共价键,则阴离子A中S原子含有2个成键电子对和2个孤电子对,即其价层电子对数为4,属于sp3杂化;阴离子A中含有4个Ge和10个S,其中4个S只形成一个共价键,则还要得到一个电子才能形成8电子稳定结构,则A离子带有4个负电荷,即离子的化学式为[Ge4S10]4-;
(5)晶胞中N原子位于顶点和面心上,则原子数目=8×![]() +6×
+6×![]() =4,B原子位于晶胞内,则原子数目为4,故氮化硼的化学式为BN;由晶胞结构可知,B原子位于4个N原子形成的四面体的中心位置,故B原子填充N原子的正四面体空隙;晶胞的质量=
=4,B原子位于晶胞内,则原子数目为4,故氮化硼的化学式为BN;由晶胞结构可知,B原子位于4个N原子形成的四面体的中心位置,故B原子填充N原子的正四面体空隙;晶胞的质量= ![]() ,晶胞的体积为a3cm3,根据晶胞密度ρ=
,晶胞的体积为a3cm3,根据晶胞密度ρ= 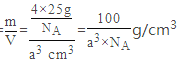 。
。