题目内容
18.在50mL 0.2mol•L-1MgCl2溶液中加入等体积的0.2mol•L-1的氨水,有无Mg(OH)2沉淀生成?已知:Mg(OH)2的Ksp=1.8×10-10,氨水的Kb=1.78×10-5.
分析 在50mL 0.2mol•L-1MgCl2溶液中加入等体积的0.2mol•L-1的氨水,则所得溶液中镁离子的浓度和氨水的总浓度均为0.1mol•L-1,根据Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$可计算出溶液中氢氧根的浓度,再将溶液中c(Mg2+)•c2(OH-)与Ksp比较可判断有无Mg(OH)2沉淀生成.
解答 解:在50mL 0.2mol•L-1MgCl2溶液中加入等体积的0.2mol•L-1的氨水,则所得溶液中镁离子的浓度和氨水的总浓度均为0.1mol•L-1,根据Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$可知,溶液中c(OH-)=$\sqrt{1.78×10{\;}^{-5}×0.1}$mol•L-1=$\sqrt{1.78}×1{0}^{-3}$mol•L-1,所以溶液中c(Mg2+)•c2(OH-)=0.1×($\sqrt{1.78}×1{0}^{-3}$)2=1.78×10-7>Ksp=1.8×10-10,所以有Mg(OH)2沉淀生成,
答:有沉淀生成.
点评 本题考查了溶度积常数的含义和计算及电离平衡常数的计算,题目难度不大,注意基本概念的应用.

练习册系列答案
相关题目
8.下列实验中所选用的仪器或者所测数据合理的是( )
| A. | 用精密pH试纸测定血液的pH为7.40 | |
| B. | 用碱式滴定管量取20.10mLKMnO4酸性溶液 | |
| C. | 用托盘天平称取8.56g食盐 | |
| D. | 用250mL容量瓶配制所需的230mL0.2 mol•L-1的氢氧化钠溶液 |
9.下列反应中,属于吸热反应的是( )
| A. | Ba(OH)2.8H2O与NH4Cl反应 | B. | 铝与稀盐酸 | ||
| C. | NaOH与HCl的反应 | D. | 甲烷与O2的燃烧反应 |
6.短周期主族元素X、Y、Z在元素周期表中的相对位置如图,下列推论合理的是( )
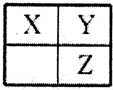
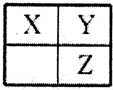
| A. | 若Z的核电荷数是Y的两倍,则X为碳元素 | |
| B. | 若X、Y、Z的单质常温下都是气体,则Y为氧元素 | |
| C. | 若X、Y、Z都是非金属元素,则它们气态氢化物的水溶液都显酸性 | |
| D. | 若X、Y、Z的原子序数之和等于25,则它们都是非金属元素 |
10.在恒容密闭容器中进行N2+3H2═2NH3反应,起始时N2和H2分别为10mol和30mol,当达到平衡时,N2的转化率为30%.若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是( )
| A. | 40 mol 35% | B. | 20 mol 30% | C. | 20 mol 70% | D. | 10 mol 50% |
8.下列说法或表示法正确的是( )
| A. | 需要加热的反应说明不一定是吸热反应 | |
| B. | 氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量少 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的稀硫酸与含1molNaOH的溶液混合,放出的热量等于57.kJ | |
| D. | 1molC完全燃烧放热393.5 kJ,其热化学方程式为:C(s)+O2(g)═CO2(g)△H=-393.5 kJ/mol |
 .
.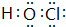 ,该化合物分子内存在共价键,E的钠盐属于离子化合物.
,该化合物分子内存在共价键,E的钠盐属于离子化合物.