题目内容
8.下列说法或表示法正确的是( )| A. | 需要加热的反应说明不一定是吸热反应 | |
| B. | 氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量少 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的稀硫酸与含1molNaOH的溶液混合,放出的热量等于57.kJ | |
| D. | 1molC完全燃烧放热393.5 kJ,其热化学方程式为:C(s)+O2(g)═CO2(g)△H=-393.5 kJ/mol |
分析 A、吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量;
B、根据气态水变为液态水放热判断;
C、中和热是指强酸强碱的稀溶液完全反应生成1mol水放出的热量;
D、1molC完全燃烧生成二氧化碳,结合热化学方程式书写方法写出分析判断;
解答 解:A、需要加热的反应不一定是吸热反应,如铝热反应需要高温下发生,属于放热反应,故A正确;
B、气态水变为液态水放热,则氢气与氧气反应生成等量的水蒸气和液态水,后者放出热量多,故B错误;
C、在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的稀硫酸与含1molNaOH的溶液混合,放出的热量等于57.kJ,故C正确;
D、1molC未说明是固体还是气体完全燃烧放热393.5 kJ,不能书写热化学方程式,故D错误;
故选CD.
点评 本题考查了热化学方程式书写,中和热、燃烧热概念的理解应用,掌握接触室解题关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g)?2/3Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
(1)该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$,△H<0(填“>”、“<”或“=”);
(2)在一个容积为5L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时比较v(正)> v(逆) (填“>”“=”“<”),反应经过2min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.06mol.L-1.min-1,CO的平衡转化率=60%;
(3)、欲提高(2)中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂.
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)在一个容积为5L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时比较v(正)> v(逆) (填“>”“=”“<”),反应经过2min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.06mol.L-1.min-1,CO的平衡转化率=60%;
(3)、欲提高(2)中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂.
13.下列关于电离度α的叙述正确的是( )
①α与浓度无关;②α值随温度升高而增大;③在相同条件下,α值的大小可以表示弱电解质的相对强弱;④α值增大,相应离子浓度一定增大;⑤α值增大相应离子物质的量增大.
①α与浓度无关;②α值随温度升高而增大;③在相同条件下,α值的大小可以表示弱电解质的相对强弱;④α值增大,相应离子浓度一定增大;⑤α值增大相应离子物质的量增大.
| A. | ①②③ | B. | ①②④ | C. | ③④⑤ | D. | ②③ |
20.下列事实不能用勒沙特列原理解释的是( )
| A. | 氯化镁溶液加热蒸干最终得不到氯化镁固体 | |
| B. | 实验室可用排饱和食盐水的方法收集氯气 | |
| C. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| D. | 压缩氢气与碘蒸气反应的平衡混合气体,颜色变深 |
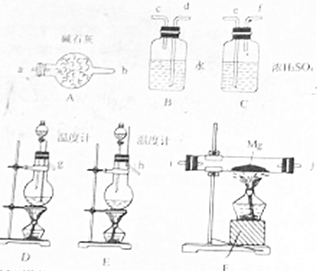 用以下反应制取氮气:NaNO2+NH4Cl$\underset{\stackrel{65℃}{=}}{△}$NaCl+N2↑+2H20,已知氮化镁易与水反应,Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓在设计装置时必须考虑这一点:
用以下反应制取氮气:NaNO2+NH4Cl$\underset{\stackrel{65℃}{=}}{△}$NaCl+N2↑+2H20,已知氮化镁易与水反应,Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓在设计装置时必须考虑这一点: 学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.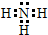 ,空间构型为三角锥形.
,空间构型为三角锥形.