题目内容
6.短周期主族元素X、Y、Z在元素周期表中的相对位置如图,下列推论合理的是( )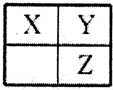
| A. | 若Z的核电荷数是Y的两倍,则X为碳元素 | |
| B. | 若X、Y、Z的单质常温下都是气体,则Y为氧元素 | |
| C. | 若X、Y、Z都是非金属元素,则它们气态氢化物的水溶液都显酸性 | |
| D. | 若X、Y、Z的原子序数之和等于25,则它们都是非金属元素 |
分析 由短周期主族元素相对位置,可知X、Y处于第二周期,Z处于第三周期.
A.若Z的核电荷数是Y的两倍,则Y为O元素、Z为S元素,可知X为N元素;
B.若X、Y、Z的单质常温下都是气体,Z只能为Cl,可知Y为F元素,X为O元素;
C.X或Y可以为N元素;
D.设Y原子序数为y,则X原子序数为y-1,Z的原子序数为y+8,原子序数之和计算,进而推断各元素.
解答 解:由短周期主族元素相对位置,可知X、Y处于第二周期,Z处于第三周期.
A.若Z的核电荷数是Y的两倍,则Y为O元素、Z为S元素,可知X为N元素,故A错误;
B.若X、Y、Z的单质常温下都是气体,Z只能为Cl,可知Y为F元素,X为O元素,故B错误;
C.X或Y可以为N元素,氨气水溶液呈碱性,故C错误;
D.设Y原子序数为y,则X原子序数为y-1,Z的原子序数为y+8,则y+y-1+y+8=25,解得y=6,则Y为C元素、Z为Si元素、X为B元素,均为非金属元素,故D正确,
故选:D.
点评 本题考查位置结构性质关系应用,需要学生熟练掌握周期表的结构,注意理解同主族元素原子序数关系.

练习册系列答案
相关题目
17. 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
已知:①Na2S2O3在酸性溶液中不能稳定存在;
②硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2→S4O62-+2I-.
(Ⅰ)制备Na2S2O3•5H2O
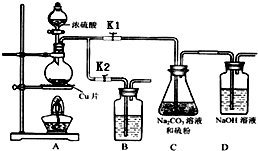
①打开K1,关闭K2,向放有铜片的圆底烧瓶中加入足量浓硫酸,加热.圆底烧瓶中发生反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②C中混合液被气流搅动,反应一段时间后,
硫粉的量逐渐减少.
C中碳酸钠的作用是提供碱性环境,作反应物.
D中可能发生的离子反应方程式为:SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O.
“停止C中的反应”的操作是打开K2,关闭K1.
③过滤C中的混合液.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
④装置B中盛放的试剂是(填化学式)NaOH溶液,其作用是在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染.
(Ⅱ)用I2的标准溶液测定产品的纯度
取5.5g产品,配制成100mL溶液.取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如下表所示.
(1)滴定时,达到滴定终点的现象是加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变.
(2)Na2S2O3•5H2O在产品中的质量分数是90.2%(用百分数表示,且保留1位小数).
 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:①Na2S2O3在酸性溶液中不能稳定存在;
②硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2→S4O62-+2I-.
(Ⅰ)制备Na2S2O3•5H2O
①打开K1,关闭K2,向放有铜片的圆底烧瓶中加入足量浓硫酸,加热.圆底烧瓶中发生反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②C中混合液被气流搅动,反应一段时间后,
硫粉的量逐渐减少.
C中碳酸钠的作用是提供碱性环境,作反应物.
D中可能发生的离子反应方程式为:SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O.
“停止C中的反应”的操作是打开K2,关闭K1.
③过滤C中的混合液.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
④装置B中盛放的试剂是(填化学式)NaOH溶液,其作用是在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染.
(Ⅱ)用I2的标准溶液测定产品的纯度
取5.5g产品,配制成100mL溶液.取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如下表所示.
| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
(2)Na2S2O3•5H2O在产品中的质量分数是90.2%(用百分数表示,且保留1位小数).
14.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | CO2的电子式 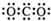 | B. | N2的电子式  | ||
| C. | 乙烯的结构简式 C2H4 | D. | -OH的电子式 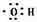 |
1.表中对于相关物质的分类全部正确的一组是( )
| 纯净物 | 混合物 | 盐 | 电解质 | 碱性氧化物 | |
| A | 氯水 | 蔗糖 | 纯碱 | NaHCO3 | 氧化铝 |
| B | 稀硫酸 | 水玻璃 | 小苏打 | NH3•H2O | 氧化镁 |
| C | 冰 | 王水 | 苏打 | H2SiO3 | 过氧化钠 |
| D | 乙醇 | 碘化银胶体 | 碱式碳酸铜 | NaOH | 氧化钠 |
| A. | A | B. | B | C. | C | D. | D |
11.下列现象或事实能用同一原理解释的是( )
| A. | 氯化铵晶体和碘晶体加热都产生气体 | |
| B. | KMnO4、二氧化锰分别与浓盐酸混合(可加热),都产生黄绿色气体 | |
| C. | 常温下铁和铂都不溶于浓硝酸 | |
| D. | SO2通入BaCl2溶液至饱和,再加入硝酸或苛性钠溶液,都能产生白色沉淀 |
