题目内容
【题目】某化学研究性学习小组模拟工业上从浓缩的海水中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知:![]() 的沸点为59℃,微溶于水,有毒。
的沸点为59℃,微溶于水,有毒。
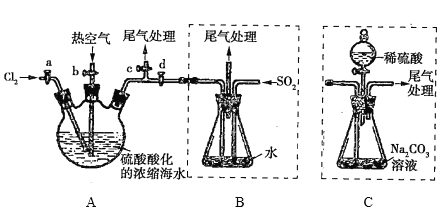
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入![]() 至反应完全;
至反应完全;
②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量![]() ;
;
④关闭活塞b,打开活塞a,再通过A向B中缓慢通人足量![]() ;
;
⑤将B中所得液体进行萃取、分液、蒸馏并收集液溴。
请回答下列问题:
(1)实验室中制备氯气的化学方程式为________________________________________________。
(2)步骤②中鼓入热空气的作用是_______________________________________。
(3)步骤③中发生的主要反应的离子方程式为_______________________________________。
(4)进行步骤③时,B中尾气可用_____(填序号)吸收处理。
a.水 b.浓硫酸 c. ![]() 溶液 d.饱和
溶液 d.饱和![]() 溶液
溶液
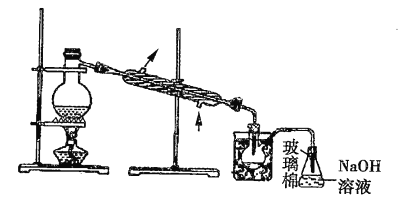
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的主要仪器补画出来___________。
(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了![]() 等物质,该反应的化学方程式为_______________。
等物质,该反应的化学方程式为_______________。
(7)与B装置相比,采用C装置的优点为______________________________________。
【答案】![]() 使A中生成的
使A中生成的![]() 随热空气流入B中
随热空气流入B中 ![]() c 缺少的主要仪器为①②③,如下图
c 缺少的主要仪器为①②③,如下图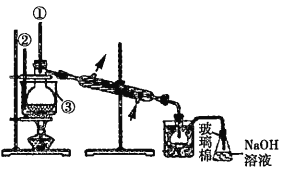
![]() 操作简单、污染小
操作简单、污染小
【解析】
实验通过反应Cl2+2Br-=2Cl-+Br2从浓缩的海水中提取溴;再利用溴单质易挥发、溴单质与二氧化硫的反应,对溴单质进行收集。
(1)实验室中制备氯气常用二氧化锰和浓盐酸反应:![]() 。
。
(2)鼓入热空气是为了将A中生成的![]() 吹入B中。
吹入B中。
(3)步骤③中发生的主要反应是Br2被二氧化硫还原为![]() 的反应,离子方程式是
的反应,离子方程式是![]() 。
。
(4)B中尾气含有![]() 、
、![]() 等,可用氢氧化钠溶液吸收。
等,可用氢氧化钠溶液吸收。
(5)蒸馏时需要温度计测定温度,为了使液体受热均匀,需采取水浴加热。
(6)![]() 与碳酸钠溶液反应生成
与碳酸钠溶液反应生成![]() ,根据氧化还原反应规律可知,该反应还生成了
,根据氧化还原反应规律可知,该反应还生成了![]() ,即
,即![]() 。
。
(7)对比B、C装置可知,采用C装置的优点为操作简单,污染小(减少二氧化硫的排放)。

 阅读快车系列答案
阅读快车系列答案【题目】(I)已知在448℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应
2HI(g)的平衡常数K1为49,则该温度下反应![]() H2(g)+
H2(g)+![]() I2(g)
I2(g)![]() HI(g)的平衡常数K2为____________。
HI(g)的平衡常数K2为____________。
(II)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________(填“吸热”或“放热”)反应。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
(5)在800℃时,发生上述反应,某时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,则下一时刻,反应将________(填“正向”或“逆向”)进行。
【题目】为探究![]() 、
、![]() 与盐酸(浓度为
与盐酸(浓度为![]() )反应过程中的热效应,实验测得的数据如表所示:
)反应过程中的热效应,实验测得的数据如表所示:
序号 | 35mL试剂 | 固体 | 混合前温度/℃ | 混合后温度/℃ |
① | 水 | 2.5g | 20.0 | 18.5 |
② | 水 | 3.2g | 20.0 | 24.3 |
③ | 盐酸 | 2.5g | 20.0 | 16.2 |
④ | 盐酸 | 3.2g | 20.0 | 25.1 |
由此得出的结论正确的是( )
A.![]() 固体与盐酸的反应是吸热反应
固体与盐酸的反应是吸热反应
B.![]() 固体与盐酸的反应是放热反应
固体与盐酸的反应是放热反应
C.20.0℃时,含3.2g![]() 的饱和溶液和35mL盐酸混合后的温度将低于25.1℃
的饱和溶液和35mL盐酸混合后的温度将低于25.1℃
D.20.0℃时,含2.5g![]() 的饱和溶液和35mL盐酸混合后的温度将低于16.2℃
的饱和溶液和35mL盐酸混合后的温度将低于16.2℃