题目内容
【题目】利用微生物可实现苯酚(![]() )废水的净化,装置如图所示。下列有关说法正确的是
)废水的净化,装置如图所示。下列有关说法正确的是
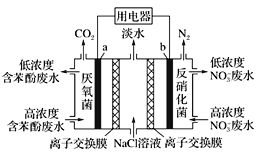
A. a极的电极反应式为:C6H5OH-28e-+11H2O=6CO2↑+28H+
B. b极为正极,发生氧化反应
C. 中间室的Na+向左室移动
D. 右室生成0.1 mol N2时,用电器流过0.5 mol电子
【答案】A
【解析】
该原电池中,硝酸根离子得电子发生还原反应,则装置右边b电极为正极,电极反应为2NO3-+10e-+12H+=N2↑+6H2O,装置左边a极苯酚失电子发生氧化反应生成二氧化碳,电极反应为C6H5OH-28e-+11H2O=6CO2↑+28H+,结合原电池的工作原理作答。
根据上述分析可知,
A. a极为原电池的负极,发生的电极反应为:C6H5OH-28e-+11H2O=6CO2↑+28H+,A项正确;
B. b极为正极,发生还原反应,B项错误;
C. 中间室的Na+向原电池的正极(b极)移动,即向右室移动,C项错误;
D. 右室中的电极反应为2NO3-+10e-+12H+=N2↑+6H2O,则生成0.1 mol N2时,用电器流过1 mol电子,D项错误;
答案选A。

【题目】碱式碳酸铜可用作木材防腐剂、水体杀藻剂等,研究性学习小组设计以下方案制备碱式碳酸铜并进行相关实验探究。
Ι.以铜屑为原料制备碱式碳酸铜的装置如下:
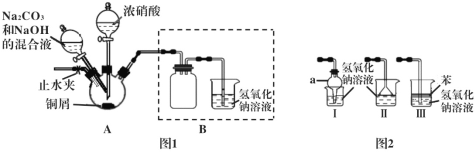
步骤1 连接好装置,检查装置的气密性,装药品。
步骤2 往三颈烧瓶中加入适量的浓硝酸,使铜屑完全反应。
步骤3 往步骤2反应后的溶液中加入一定比例的Na2CO3和NaOH的混合液,加热。
步骤4 将三颈烧瓶中的混合物过滤、洗涤、烘干,获得产物。
已知:ⅰ.碱式碳酸铜为草绿色或绿色结晶物,易溶于酸,不溶于水,在100℃的水中易分解;
ⅱ.NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO3+NaNO2+H2O;
NO不能单独与NaOH溶液反应。
(1)步骤2中浓硝酸与铜屑反应的离子方程式为___________________。
(2)步骤2反应一段时间后,须打开止水夹,通入一段时间的空气,目的是_______。
(3)步骤3对装置A的加热方式最好采用____________。
(4)装置Ι中仪器a的名称为____,Ⅰ、Ⅱ、Ⅲ三个装置不能替代图1中B装置的是_____(填装置序号)。
(5)欲检验步骤4获得的产物中是否含有NO3-,所需的试剂可以是__________。
Ⅱ.探究在一定温度下,不同的原料配比对产物的影响,实验数据如下:
实验序号 | V[Cu(NO3)2] /mL (0.5 mo1·L-1) | V(NaOH) / mL (0.5 mo1·L-1) | V(Na2CO3)/ mL (0.25 mo1·L-1) | 沉淀数量 | 沉淀颜色 |
1 | 2.0 | 2.0 | 1.6 | + | 浅绿色 |
2 | 2.0 | 2.0 | 2.0 | + + | 浅绿色 |
3 | 2.0 | 2.0 | 2.4 | + + + | 蓝色 |
4 | 2.0 | 2.0 | 2.8 | + + + | 蓝色 |
注:“+”越多表示沉淀量越多
(6)分析表格数据可得:制备碱式碳酸铜最佳的原料配比n[Cu(NO3)2]:n(NaOH) : n(Na2CO3) =___。
Ⅲ.产物组成的测定
(7)碱式碳酸铜的成分有多种,化学式可表示为mCu(OH)2·n CuCO3。为测定Ι中所得碱式碳酸铜的组成,学习小组同学准确称取3.820 g样品溶于适量的硫酸中,加水配成l00 mL溶液,取l0.00 mL溶液于锥形瓶中,加适量水稀释,调节溶液pH至3~4,加入过量的KI(2 Cu2+ + 4 I- = 2 CuI↓ + I2),用0.l000 mol·L-1 Na2S2O3标准溶液滴定(2 S2O32- + I2 = 2I- + S4O62-),接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失。进行平行实验后,测得平均消耗Na2S2O3标准溶液的体积为35.00 mL。该碱式碳酸铜的化学式为_____
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化