题目内容
【题目】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态Ga原子价电子排布式__________________,核外电子占据最高能级的电子云形状为_________;基态As原子最高能层上有_______个电子。
(2)镓失去电子的逐级电离能(单位:kJmol1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____和+3,砷的第一电离能比镓_____(填“大”或“小”)。
(3)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为__________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中Ga原子的杂化方式为______,AsH3分子的空间构型为____________。
(5)相同压强下,AsH3的沸点______NH3(填“大于”或“小于”),原因为__________________
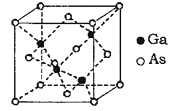
(6)GaAs为原子晶体,其晶胞结构如图所示,Ga与As以___________(填“共价键”或“离子键”)键合。设阿伏伽德罗常数的值为NA,该晶胞边长为a pm,则GaAs晶体的密度为_____gcm3(列出计算式即可)。
【答案】4s24p1 哑铃形(或纺锤形) 5 +1 大 V、Co sp2 三角锥形 小于 NH3与AsH3的结构相似,NH3分子间能形成氢键,沸点更高 共价键 ![]()
【解析】
(1) Ga位于周期表中第4周期第ⅢA族,As位于周期表中第4周期第ⅤA族;
(2)根据电离能差值分析元素的化合价,电离能差值过大说明失去该电子较困难,同周期元素随着原子序数增大,电负性增强,同主族元素随着原子序数增大,电负性减小;
(3)基态As原子核外1s22s22p63d104s24p3或[Ar]3d104s24p3,核外未成对电子数目为3;
(4)利用价层电子对互斥模型判断原子杂化方式;As与N同主族位于第VA族其氢化物的结构与氨气相同;
(5) NH3分子间能形成氢键;
(6)GaAs为原子晶体,原子间以共价键结合;利用均摊法计算一个晶胞中含有的As、Ga原子数,通过计算晶胞体积、晶胞中As、Ga的总质量就可计算出密度。
(1)Ga为31号元素,核外有31个电子,基态镓(Ga)原子的电子排布式为1s22s22p63s23p63d104s24p1,核外电子占据最高能级为4p,电子云形状为哑铃形;As元素的基态原子核外电子排布式1s22s22p63d104s24p3,最高能层上有5个电子;
(2)根据Ga失去电子的逐级电离能数值,第一电离能和第二电离能差值较大,且第三电离能和第四电离能数值差别较大,说明失去第二个电子和失去第四个电子较困难,所以呈现的价态是+1和+3;Ga、As是同一周期的元素,一般情况下,同一周期的元素,原子序数越大,元素的非金属性越强,其电负性越大,所以电负性As>Ga;
(3)基态As原子核外1s22s22p63d104s24p3或[Ar]3d104s24p3,核外未成对电子数目为3,第四周期元素中,基态V原子核外电子排布式为1s22s22p63s23p63d34s2,基态Co原子核外电子排布式为:1s22s22p63s23p63d74s2,以上两种元素核外未成对电子数目都为3;
(4)(CH3)3Ga中Ga形成3个σ键,没有孤电子对,所有Ga原子的杂化方式为sp2杂化;As与N同主族位于第VA族,其氢化物的结构与氨气相同,则AsH3分子的空间构型为三角锥形;
(4)N原子半径较小,电负性较大,对应的NH3分子间能形成氢键,沸点较高,而As电负性小,半径大,分子间不能形成氢键,沸点较低;
(6)GaAs为原子晶体,原子间以共价键结合,利用均摊法计算一个晶胞中含有的As、Ga原子数,As:8×18+6×12=4,Ga:4×1=4,即一个晶胞中含有4个GaAs;晶胞的质量m=![]() g,晶胞的体积V=(apm)3=(a×10-10cm)3=a3×10-30cm3,则晶胞的密度=
g,晶胞的体积V=(apm)3=(a×10-10cm)3=a3×10-30cm3,则晶胞的密度=![]() =
= =
=![]() 。
。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案