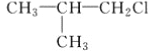题目内容
【题目】为研究卤代烃的化学性质,某化学课外小组的学生进行了如下实验。
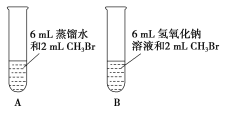
(1)甲同学设计了A、B两个实验,充分振荡反应后,甲先从试管A的水层中取出少量溶液,滴入盛装有硝酸酸化的硝酸银溶液的试管中,观察到的实验现象是____;后从试管B(NaOH溶液的浓度是0.5 mol·L-1)的水层中取出少许溶液,滴入盛有足量硝酸酸化的硝酸银溶液的试管中,观察到的实验现象是____,写出该反应的化学方程式:____。A、B两个实验说明____。
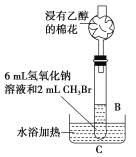
(2)乙同学在B的基础上设计装置C,研究氢氧化钠溶液和CH3Br的反应。浸有乙醇的棉花的作用是____,有人认为,控制装置C中水浴温度是本实验的关键,则应控制水浴温度低于____的沸点。
(3)丙同学将NaOH溶液的浓度从0.5 mol·L-1增大到1.0 mol·L-1、1.5 mol·L-1,经过相同的时间(试管中还有油滴)后从试管B的水层中取出少许溶液,滴入盛有足量硝酸酸化的硝酸银溶液的试管中,发现生成沉淀的质量依次增大,该现象说明____,还可以通过其他实验操作说明该结论,简述另一种实验思想:____。
【答案】无现象 有浅黄色沉淀生成 NaBr + AgNO3 = NaNO3 + AgBr↓ 甲醇发生水解反应,要在碱性条件下才反应 吸收CH3Br,防止在CH3Br逸出,污染环境 CH3Br 氢氧化钠浓度越大,水解速率越快,单位时间内生成生成的HBr越多,产生的AgBr沉淀就越多 比较生成相同量的AgBr,不同浓度NaOH消耗时间的长短
【解析】
(1)A中不反应,CH3Br是非电解质,不能直接和硝酸银反应,B中发生水解反应,水层再加入硝酸银反应生成淡黄色硝酸银。
(2)CH3Br易挥发,乙醇可以吸收CH3Br。
(3)根据NaOH溶液的浓度越大,反应速率越快,相同时间内生成NaBr越多或生成相同量的AgBr,浓度较大的NaOH溶液消耗时间越短分析。
(1)甲先从试管A的水层中取出少量溶液,滴入盛装有硝酸酸化的硝酸银溶液的试管中,两者不反应,因此观察到的实验现象是无现象;试管B中反应生成甲醇和溴化钠,后从试管B(NaOH溶液的浓度是0.5 mol·L-1)的水层中,取出少许溶液,滴入盛有足量硝酸酸化的硝酸银溶液的试管中,观察到的实验现象是有浅黄色沉淀生成,该反应的化学方程式: NaBr + AgNO3 = NaNO3 + AgBr↓,A、B两个实验说明甲醇发生水解反应,要在碱性条件下才反应;故答案为:无现象;有浅黄色沉淀生成;NaBr + AgNO3 = NaNO3 + AgBr↓;甲醇发生水解反应,要在碱性条件下才反应。
(2) CH3Br易挥发,乙醇可以吸收CH3Br,防止在加热过程中CH3Br逸散到空气中,污染环境,用温度计控制水浴加热温度且温度低于CH3Br的沸点;故答案为:吸收CH3Br,防止在CH3Br逸出,污染环境;CH3Br。
(3)滴入盛有足量硝酸酸化的硝酸银溶液的试管中,发现生成沉淀的质量依次增大,说明氢氧化钠浓度越大,水解速率越快,单位时间内生成生成的HBr越多,产生的AgBr沉淀就越多,还可以比较生成相同量的AgBr,不同浓度NaOH消耗时间的长短来说明该结论;故答案为:氢氧化钠浓度越大,水解速率越快,单位时间内生成生成的HBr越多,产生的AgBr沉淀就越多;比较生成相同量的AgBr,不同浓度NaOH消耗时间的长短。

【题目】以磷石膏(只要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3。
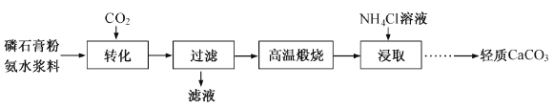
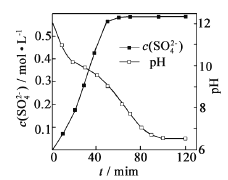
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见由右图。清液pH>11时CaSO4转化的离子方程式_____________;能提高其转化速率的措施有____(填序号)
A.搅拌浆料 | B.加热浆料至100℃ |
C.增大氨水浓度 | D.减小CO2通入速率 |
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为______和________(填化学式);检验洗涤是否完全的方法是_________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因___________。