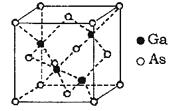
题目内容
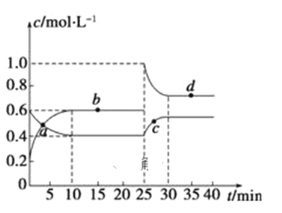
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) △H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示:
2NO2(g) △H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示:
(1)该温度下,若温度升高,K值将___________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是_____点。
(3)25 min时,加入了___________填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度_____(填“大于”、“小于”或“等于”)0.8 mol/L,理由是_____________________。
【答案】增大 b、d 0.8 mol NO2 小于 假设平衡时NO2的浓度为0.8 mol/L,则此时Qc=1.28>K=0.9,平衡要逆向移动,使NO2的浓度降低,所以平衡时NO2的浓度小于0.8 mol/L。
【解析】
(1)根据反应热,结合温度对化学平衡移动的影响分析;
(2)根据图象及物质的浓度不发生变化时表示化学反应处于平衡状态;
(3)c(NO2)瞬间增大,比平衡状态物质的量增加了(1-0.6)mol/L×2 L=0.8 mol;
(4)假设平衡时二氧化氮的浓度为0.8 mol/L,根据Qc= 与K的关系判断。
与K的关系判断。
(1)由N2O4(g)![]() 2NO2(g) △H>0可知该反应的正反应为吸热反应,升高温度,化学平衡向吸热的正反应正向移动,所以化学平衡常数K增大;
2NO2(g) △H>0可知该反应的正反应为吸热反应,升高温度,化学平衡向吸热的正反应正向移动,所以化学平衡常数K增大;
(2)由图可知,10~25 min及30 min之后各物质的物质的量浓度不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,故合理选项是bd;
(3)利用25min后的物质的浓度变化可知在25 min时加入了NO2,其加入的物质的量=(1.0 mol/L-0.6 mol/L)×2L=0.8 mol;
(4)由图象可知在该温度下,当反应处于平衡状态时,c(NO2)=0.6 mol/L,c(N2O4)=0.4mol/L,所以该稳定性的化学平衡常数K=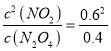 =0.9,假设加入NO2气体,反应达到平衡时二氧化氮的浓度为0.8 mol/L,则此时Qc=
=0.9,假设加入NO2气体,反应达到平衡时二氧化氮的浓度为0.8 mol/L,则此时Qc=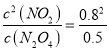 ==1.28>K=0.9,则平衡要向逆反应方向移动,使二氧化氮的浓度降低,所以平衡时二氧化氮的浓度小于0.8 mol/L。
==1.28>K=0.9,则平衡要向逆反应方向移动,使二氧化氮的浓度降低,所以平衡时二氧化氮的浓度小于0.8 mol/L。