题目内容
20.Ⅰ.已知常温下,在NaHSO4溶液中,c(H2SO3)<c(SO32-),且H2SO3的电离平衡常数为K1=1.5×10-2,K2=1.1×10-2;氨水的电离平衡常数为1.8×10-5;回答下列问题:(1)NH4Cl溶液中离子浓度由大到小的次序为c(Cl-)>c(NH4+)>c(H+)>c(OH-)
(2)等物质的量浓度的下列五种溶液:①NH3•H2O②(NH4)2SO3③KHSO3④K2SO3⑤H2SO3溶液中水的电离程度由大到小的排列顺序为②④③①⑤(填序号).
(3)NaHSO3可以将碘盐中的KIO3还原为碘单质,试写出此反应的离子方程式5HSO3-+2IO3-=I2+5SO42-+3H++H2O.
分析 (1)氯化铵溶液中,铵根离子部分水解,溶液显示酸性,c(H+)>c(OH-),再结合电荷守恒判断各离子浓度大小;
(2)酸溶液和碱溶液抑制了水的电离,能够水解的盐溶液促进了水的电离,结合亚硫酸和一水合氨的电离平衡常数进行判断;
(3)NaHSO3被氧化为SO42-,同时KIO3被还原为碘离子.
解答 解:(1)氯化铵溶液中铵根离子部分水解:NH4++H2O?NH3•H2O+H+,则:c(H+)>c(OH-)、c(Cl-)>c(NH4+),溶液中离子浓度由大到小顺序为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)等物质的量浓度的下列五种溶液:①NH3•H2O②(NH4)2SO3③KHSO3④K2SO3⑤H2SO3溶液:①和⑤都抑制了水的电离,其中⑤亚硫酸的电离平衡常数大于大于①氨水,则⑤中水的电离程度小于①;③中亚硫酸氢根离子的电离程度大于其水解程度,溶液稀释弱酸性,抑制了水的电离;②中亚硫酸根离子、铵根离子促进了水的电离;④中亚硫酸根离子促进了水的电离,其中②对水的电离程度大于④,所以五种溶液水的电离程度由大到小的排列顺序为:②④③①⑤,
故答案为:②④③①⑤;
(3)NaHSO3被氧化为SO42-,同时KIO3被还原为碘离子,其反应的离子方程式为:5HSO3-+2IO3-=I2+5SO42-+3H++H2O;
故答案为:5HSO3-+2IO3-=I2+5SO42-+3H++H2O.
点评 本题考查了离子浓度大小比较、离子方程式书写,题目难度中等,明确盐的水解及其影响为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列说法正确的是( )
| A. | 含氧元素的化合物都是氧化物 | B. | 含氢元素的化合物都是酸 | ||
| C. | 冰水混合物不是纯净物 | D. | 只含一种元素的物质不一定是单质 |
8.下列溶液在常温下pH<7的是 ( )
| A. | KCl溶液 | B. | CH3CH2OH溶液 | C. | CH3COOH溶液 | D. | NaOH溶液 |
5.设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 6g SiO2晶体中含有0.4NA个Si-O键 | |
| B. | PH=12的Na2CO3中有0.01NA个水分子发生了电离 | |
| C. | 标况下,11.2LHF含有的HF分子数大于0.5NA | |
| D. | 把含1molFeCl3的饱和溶液滴入沸水煮沸至红褐色透明,停止加入后,小于1NA |
12.作为基本化学工业之一的氯碱工业,是通地电解饱和食盐水得到NaOH、Cl2和H2,有关电解产物的说法正确的是( )
| A. | H2不能在Cl2中燃烧 | B. | 在阳极得到H2 | ||
| C. | NaOH是弱碱 | D. | Cl2可用于制造漂白粉 |
14.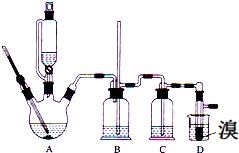 实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
有关数据列表如下:
回答下列问题:
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的两步反应方程式为C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2=CH2+Br2→CH2BrCH2Br.
(2)在此实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰
水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
 实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的两步反应方程式为C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2=CH2+Br2→CH2BrCH2Br.
(2)在此实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰
水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.