题目内容
【题目】对甲烷和CO2的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合CO2重整反应有:
反应(i):2CH4(g)+O2(g)![]() 2CO(g)+4H2(g) △H=-71.4kJmol-1
2CO(g)+4H2(g) △H=-71.4kJmol-1
反应(ii):CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247.0kJmol-1
2CO(g)+2H2(g) △H=+247.0kJmol-1
(1)写出表示CO燃烧热的热化学方程式:_____。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)(不发生其它反应),CO2的平衡转化率如下表所示:
2CO(g)+2H2(g)(不发生其它反应),CO2的平衡转化率如下表所示:
起始物质的量(n)/mol | CO2的平衡转化率 | ||||
CH4 | CO2 | CO | H2 | ||
Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
①下列能说明反应达到平衡状态是_____。
A.v正(CH4)=2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②若容器Ⅰ内反应从开始到平衡所用的时间为tmin,则tmin内该反应的平均反应速率为:v(H2)=____(用含t的表达式表示)。
③达到平衡时,容器Ⅰ、Ⅱ内CO的物质的量的关系满足:2n(CO)Ⅰ___n(CO)Ⅱ(填“>”、“=”或“<”)。
(3)将CH4(g)和O2(g)以物质的量比为4:3充入盛有催化剂的恒容密闭容器内,发生上述反应(i):2CH4(g)+O2(g)![]() 2CO(g)+4H2(g)
2CO(g)+4H2(g)

①T2℃时,CO体积分数最大的原因是____。
②若T2℃时,容器内起始压强为P0,平衡时CO的体积分数为20%,则反应的平衡常数KP=___(用平衡分压强代替平衡浓度计算,分压=总压×物质的量分数)。
(4)2016年我国科研人员根据反应Na+CO2→Na2CO3+C(未配平)研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。其放电时的工作原理如图所示,已知吸收的全部CO2中,有![]() 转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:___。
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:___。

【答案】CO(g)+![]() O2(g)=CO2(g)△H=-282.7kJmol-1 C
O2(g)=CO2(g)△H=-282.7kJmol-1 C ![]() mol/(Lmin) > 低于T2℃时,反应未达平衡,相同时间内温度越高反应速率越快,CO的体积分数就越高;高于T2℃时,反应达到平衡,因正反应为放热反应,升高温度,平衡逆向移动,故温度越高,CO的体积分数就越小;
mol/(Lmin) > 低于T2℃时,反应未达平衡,相同时间内温度越高反应速率越快,CO的体积分数就越高;高于T2℃时,反应达到平衡,因正反应为放热反应,升高温度,平衡逆向移动,故温度越高,CO的体积分数就越小; ![]() 4Na++3CO2+4e-=2Na2CO3+C(或3CO2+4e-=2CO32-+C)
4Na++3CO2+4e-=2Na2CO3+C(或3CO2+4e-=2CO32-+C)
【解析】
(1)根据盖斯定律计算出焓变,继而写出热化学方程式;
(2)①反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
②根据![]() 计算tmin内v(H2);
计算tmin内v(H2);
③将容器Ⅱ内的物料进行“一边倒”,通过等效平衡思想进行分析;
(3)①没有达到平衡状态时,温度升高、反应速率加快,当达到平衡状态后,升高温度平衡向着逆向移动,据此分析;
②恒容密闭容器中压强之比等于物质的量之比,等于浓度之比,CH4(g)和O2(g)的物质的量之比为4:3,可先假设CH4物质的量为4x,O2为3x,平衡时生成CO的物质的量为ymol,利用三段式求解;
(4)放电时正极得电子发生还原反应。
(1)反应(i):2CH4(g)+O2(g)2CO(g)+4H2(g)△H=-71.4kJmol-1
反应(ii):CH4(g)+CO2(g)2CO(g)+2H2(g)△H=+247.0kJmol-1
根据盖斯定律![]() [反应(i)-反应(ii)]可得CO(g)+
[反应(i)-反应(ii)]可得CO(g)+![]() O2(g)=CO2(g)的△H=
O2(g)=CO2(g)的△H=![]() [-71.4kJmol-1-(+247.0kJmol-1)×2]=-282.7kJmol-1,即CO燃烧热的热化学方程式为CO(g)+
[-71.4kJmol-1-(+247.0kJmol-1)×2]=-282.7kJmol-1,即CO燃烧热的热化学方程式为CO(g)+![]() O2(g)=CO2(g)△H=-282.7kJmol-1,
O2(g)=CO2(g)△H=-282.7kJmol-1,
故答案为:CO(g)+![]() O2(g)=CO2(g)△H=-282.7kJmol-1;
O2(g)=CO2(g)△H=-282.7kJmol-1;
(2)在容器Ⅰ(体积为2L)中反应三段式为:

①A.反应平衡时v正(CH4)=v逆(CH4) ,2v逆(CH4)=v逆(CO),所以平衡时2v正(CH4)=v逆(CO),故A错误;
B. 由反应三段式计算该温度下的平衡常数K=![]() ,而c(CH4)c(CO2)=c2(CO)c2(H2)的状态有:浓度熵Qc=1>K,反应逆向进行,即不是平衡状态,故B错误;
,而c(CH4)c(CO2)=c2(CO)c2(H2)的状态有:浓度熵Qc=1>K,反应逆向进行,即不是平衡状态,故B错误;
C.反应CH4(g)+CO2(g)2CO(g)+2H2(g)是气体体积变化的反应,反应进行时气体总物质的量发生变化,容器中压强也发生变化,所以容器内混合气体的总压强不再变化的状态是平衡状态,故C正确;
D.反应体系中各物质均为气体,则混合气体的质量m不变,恒温恒容条件下V不变,根据![]() 可知,容器内密度始终不变,所以容器内混合气体密度保持不变的状态不一定是平衡状态,故D错误;
可知,容器内密度始终不变,所以容器内混合气体密度保持不变的状态不一定是平衡状态,故D错误;
故答案为:C;
②由反应三段式可知,△c(H2)=0.05mol/L,所以tmin内v(H2)=![]() mol/(Lmin),
mol/(Lmin),
故答案为:![]() mol/(Lmin);
mol/(Lmin);
③恒温恒容条件下,0.1molCH4(g)、0.1molCO2(g)、0.2molCO(g)、0.2molH2(g)的反应体系II等效于0.2molCH4(g)、0.2molCO2(g)的反应体系,若二者达到等效平衡,则2n(CO)Ⅰ=n(CO)Ⅱ,但实际上0.2molCH4(g)、0.2molCO2(g)的反应体系相当2个容器I的体系合并后压缩,则平衡逆向逆向移动、CO物质的量减小,所以2n(CO)Ⅰ>n(CO)Ⅱ,故答案为:>;
(3)①温度低于T2℃时,反应未达平衡,温度升高、反应速率加快,相同时间段内温度越高反应速率越快,则CO的体积分数越大;在温度为T2℃时,反应达到平衡,由于该反应为放热反应,温度升高,平衡逆向移动,CO的体积分数减小,所以T2℃时CO的体积分数最大,也可能是T0℃时催化剂的催化活性最高,反应速率最快,故答案为:低于T2℃时,反应未达平衡,相同时间内温度越高反应速率越快,CO的体积分数就越高;高于T2℃时,反应达到平衡,因正反应为放热反应,升高温度,平衡逆向移动,故温度越高,CO的体积分数就越小;
②CH4(g)和O2(g)的物质的量之比为4:3,设CH4物质的量为4x,O2为3x,平衡时生成CO的物质的量为ymol,列三段式:
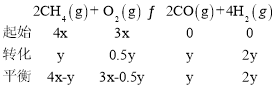
CO的平衡体积分数为20%,则:![]() ×100%=20%,解得:y=2x,
×100%=20%,解得:y=2x,
平衡时混合气体的总物质的量为:7x+1.5y=10x,反应前总物质的量为7xmol,恒温恒容条件下,气体的压强与物质的量成正比,T2℃时容器内起始压强为p0,则平衡时压强为: ![]() ,平衡时各气体的分压:平衡时p(CH4)=p(O2)=p(CO)=
,平衡时各气体的分压:平衡时p(CH4)=p(O2)=p(CO)=![]() ,p(H2)=
,p(H2)=![]() ,所以平衡常数
,所以平衡常数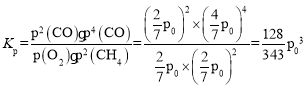 ,故答案为:
,故答案为:![]() ;
;
(4) 由原电池反应Na+CO2→Na2CO3+C可知,“吸入”的CO2得电子生成C和Na2CO3,为正极,电极反应式为4Na++3CO2+4e-=2Na2CO3+C(或3CO2+4e-=2CO32-+C),
故答案为:4Na++3CO2+4e-=2Na2CO3+C(或3CO2+4e-=2CO32-+C)。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案