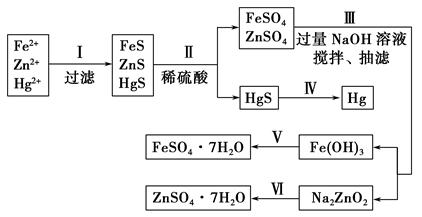
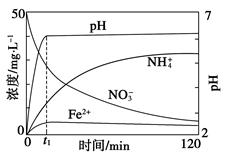
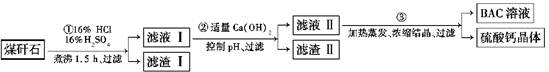
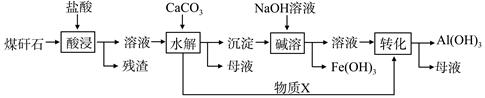
题目内容
某厂废水中含5.00×10-3 mol·L-1的Cr2O,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程: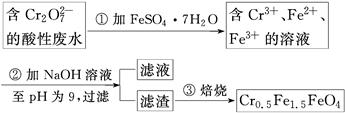
(1)第①步反应的离子方程式是________________________________________________。
(2)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有__________。
(3)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入________g FeSO4·7H2O。
(1)Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(2)Fe(OH)3、Fe(OH)2
(3)13.9
解析

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 | K+、Na+、Al3+、Cu2+ |
| 阴离子 | OH-、HCO3-、NO3-、SO42- |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象。
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、C的化学式:B ; C 。
(2)写出过量E滴人到C溶液中的离子反应方程式 。
(3)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(4)在A溶液中加澄清石灰水,其离子方程式为 。
(5)上述五种化合物中有一种是常用作净水剂,其净水原理是: (请结合方程式及必要的文字进行叙述)。