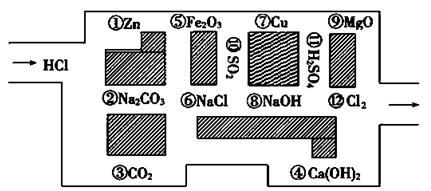
题目内容
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3 + 4 HCl=2 ClO2↑+ Cl2↑+ 2 NaCl + 2 H2O
方法二:2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+2 Na2SO4 + 2 H2O
(1)方法一的离子方程式为 。
(2)方法二中被氧化的物质是 ,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为 L。
(3)与方法一比较,用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(1)2ClO3-+ 4 H+ + 2Cl-=2 ClO2↑+ Cl2↑+ 2 H2O
(2)H2O2,2.24
(3)方法一制得的ClO2中含有Cl2
解析试题解析:(1)根据离子方程式的书写原则,易溶且易电离的电解质在书写离子方程式时写成离子形式,删去方程式两边不参加反应的离子,检查方程式两边是否满足元素守恒、电荷守恒,所以方法一的离子方程式为:2ClO3-+ 4 H+ + 2Cl-=2 ClO2↑+ Cl2↑+ 2 H2O。
(2)根据氧化还原反应理论,被氧化的物质是元素化合价升高的物质,在方法二中,化合价升高的元素是H2O2中的氧元素,所以被氧化的物质是H2O2。每生成1mol ClO2气体,则转移1mol电子,所以当有0.1mol电子转移时,则生成0.1mol ClO2气体,标准状况下的体积为2.24L。
(3)氯气用于自来水消毒时易产生对人体有害的有机氯代物,方法一中有氯气产生,所以方法二更适合制备ClO2。
考点:考查离子方程式的书写、氧化还原反应理论的运用以及化学在生活中的应用

 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案有一无色透明的溶液,要确定是否含有以下离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液实验如下:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定存在的离子是___________________________________________________________,溶液中肯定不存在的离子是__________________________________________________________________。
(2)为进一步确定其他离子,应该补充的实验及对应欲检离子的名称(如为溶液反应,说明使用试剂的名称,不必写详细操作步骤)。_________________________________________________________。
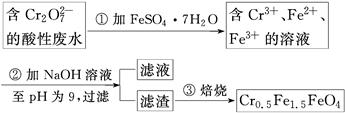
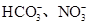 。已知该溶液可与Al2O3反应,则:
。已知该溶液可与Al2O3反应,则: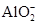 生成,则原溶液中一定含有_______,可能含有大量的_______。
生成,则原溶液中一定含有_______,可能含有大量的_______。